(I)(1)有以下10种物质:①铁 ②稀硫酸 ③氯化氢 ④氨气 ⑤空气 ⑥二氧化碳 ⑦水银 ⑧氯化镁 ⑨硫酸钡 ⑩蔗糖。其中属于电解质的是 。
(2)写出⑧在水溶液中的电离方程式 。
(3)写出①与水蒸气反应的化学方程式 。
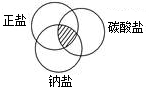
(II)对于数以万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可代替的。现有碳、二氧化碳、氧化铁、澄清石灰水、稀硫酸和碳酸钠溶液等六种物质。通过常见分类法中的 法,可推出符合图阴影的物质的化学式是 。
(III)用白磷还原法可制得一种金的分散系,该分散系在临床诊断及药物检测等方面有着广泛的应用。其操作步骤如下:
①取20%白磷的乙醚溶液0.5mL,加蒸馏水60mL。
②先滴加1%氯化金水溶液0.75 mL,再滴加0.1 mol/L的K2CO3 0.6 mL,振荡变成棕红色。
③加热煮沸至溶液变成透明红色。
④分离提纯,除去无机溶质。
所得分散系中,金颗粒直径为5~12nm。
请回答下列问题:
(1)该分散系属于 ,其分散质是 。
(2)用一束强光照射该分散系,从侧面可看到 。
(3)步骤④的分离方法是 。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出:元素o的基态原子电子排布式_________
(2)k在空气中燃烧产物的分子构型为,中心原子的杂化形式为,该分子是(填“极性”或“非极性”)分子。
(3)含10电子的d的氢化物分子的VSEPR模型为_______。元素c、a、e按原子个数1:2:1组成生活中常见有甜味分子,该分子中有___个手性碳原子。
(4)g、h、i三种元素的第一电离能由大到小的顺序为________(填元素符号)
(5) 所有元素 其中电负性最大的是___(填图中的序号或元素符号),元素k有两种氧化物,它们对应的水化物的酸性强弱顺序为__________;(填化学式)
I.已知有如下氧化还原反应:Zn+2HNO3+NH4NO3=N2↑+Zn(NO3)2+3H2O,则:
(1)该反应的还原剂为 ,还原产物为 。(写化学式)
(2)若产生的N2在标准状况下体积为2.24L,则反应中转移的电子数为 NA。
II.化学与我们的生活密切相关,请用化学方程式描述以下生活中的实例:
(1)盛有NaHCO3的干粉灭火器用于灭火
(2)铁质菜刀的“淬火”工艺:将红热的菜刀浸入水中急速冷却
(3)饲养金鱼用的自来水必须经过太阳暴晒后才能使用
由人尿分离出来的结晶化合物A,熔点为187~188 ℃。对化合物A做下列实验:
(1)测得A的蒸气密度为8.00 g·L-1(已折合成标准状况),取17.92 g A完全燃烧,生成的气体通过浓H2SO4,使浓H2SO4增重8.10 g。剩余气体通过碱石灰,气体质量减轻39.60 g;另取17.90 g A完全分解,可得标准状况下氮气1.12 L,试通过计算确定A的化学式_______。
(2)又知A和足量6 mol·L-1的盐酸混合加热可以完全水解,1 mol A水解生成1 mol B和1 molC。已知A、B、C三物质分子中均含有1个羧基;B物质仅由碳、氢、氧3种元素组成,其物质的量之比为7∶6∶2;C俗名为甘氨酸。写出A、B、C的结构简式。A_______,B_______,C_______。
紫杉醇是一种新型抗癌药,其分子式为C47H51NO14,它是由如下的A酸和B醇生成的一种酯。
A. 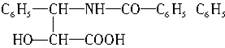 —是苯基
—是苯基
B.R—OH(R是一个含有C、H、O的基团)
(1)A可在无机酸催化下水解,其反应的方程式是___________________________。
(2)A水解所得的氨基酸,不是天然蛋白质水解产物,因为氨基不在____(填希腊字母)位。
(3)写出ROH的分子式_________________________。
科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学和医学奖。
请完成下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N 4种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是________。D是双原子分子,相对分子质量为30,则D的分子式为________。
(2)油脂A经下列途径可得到M。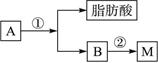
图中②的提示: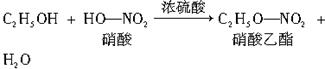
反应①的化学方程式是______________________________________________________。
反应②的化学方程式是______________________________________________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式:______________________________________________。
(4)若将0.1 mol B与足量的金属钠反应,则需消耗________g金属钠。