Ⅰ、NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是____________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1的NH4Al(SO4)2中c(NH)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH)。
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。

①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________,导致pH随温度变化的原因是__________________________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO)-c(NH)-3c(Al3+)=________(取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________________
Ⅱ、为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
| 操作步骤 |
现象 |
| 步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 |
出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 |
溶液变红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 |
现象a,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 |
出现黄色沉淀。 |
(1)写出步骤2中溶液变红色的离子方程式 。
(2)步骤3中现象a 。
(3)用化学平衡原理解释步骤4的实验现象
有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4,且A不能使Br2的CCl4溶液褪色;1mol B反应生成了2mol C。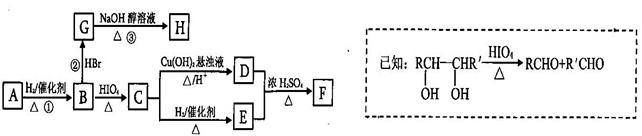
请回答下列问题:
(1)C→E的反应类型为_______________________ 。
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.09%,则由A合成H的总产率为___________________ 。
(3)A的结构简式为__________________________ 。
(4)写出C与银氨溶液反应的离子方程式为________________________________ 。
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为: ___________________。
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为____________________________。
某同学取一定量的Al、Fe混合物,与2.0L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐。在反应后的溶液中,逐滴加入4mol·L-1的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示。分析图像回答问题: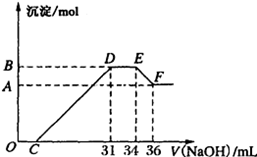
(1)DE段发生反应的离子方程式为:_____________________________________ 。
(2)请写出任意一个Al、Fe与极稀HNO3反应的化学方程式:_______________ 。
(3)B点对应的沉淀的物质的量为_______mol,C点对应的氢氧化钠溶液的体积为______mL。
(4)原硝酸溶液的物质的量浓度为_______mol/L。
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Na+、Al3+、Ba2+、NH4+ |
| 阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下:
①A、D溶液呈碱性,B呈酸性,C呈中性
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试纸变蓝
回答下列问题:
(1)A的化学式是_________,用电子式表示C的形成过程:________________ 。
(2)向A溶液中通入适量CO2,使生成的沉淀恰好溶解,所得溶液中各离子物质的量浓度由大到小的顺序是:________________________ 。
(3)写出③的离子方程式_______________________________________________ 。
(4)简述D溶液呈碱性的理由___________________________________________ 。
Heck反应是合成C—C键的有效方法之一,如反应①:
化合物Ⅱ可由以下合成路线获得:
Ⅳ(分子式C3H6O3) Ⅴ
Ⅴ Ⅱ
Ⅱ
(1) 化合物Ⅲ的分子式为__________,1 mol化合物Ⅲ最多可与__________mol H2发生加成反应。
(2)化合物Ⅳ分子结构中有甲基,写出由化合物Ⅳ反应生成化合物Ⅴ的化学方程式
________________________________________________________________________
________________________________________________________________________。
(3)有关化合物Ⅱ说法正确的是( )
| A.1 mol 化合物Ⅱ完全燃烧消耗5 mol O2 |
| B.化合物Ⅱ能使酸性高锰酸钾溶液褪色 |
| C.化合物Ⅱ难溶于水 |
D.化合物Ⅱ分子间聚合,反应生成的高聚物结构为 |
(4)化合物Ⅲ的一种同分异构体Ⅵ,苯环上的一氯取代物有两种,Ⅵ能与NaHCO3溶液反应生成无色气体,除苯环上的氢外核磁共振氢谱还有四组峰,峰面积之比为1∶1∶1∶3,Ⅵ的结构简式为________________________________________________________________________。
(5)CH3Ⅰ和O也可以发生类似反应①的反应,有机产物的结构简式为__________________________________。
已知α氨基酸与亚硝酸(HNO2)反应生成α羟基酸。如: 试根据下列6种有机物之间的转化关系,回答有关问题:
试根据下列6种有机物之间的转化关系,回答有关问题:
(1)写出有机物B和E的结构简式。
B:____________________,E:____________________。
(2)写出下列反应的化学方程式。
①A→C:________________________________________________________________________。
②D→F:________________________________________________________________________。