氨气在生产、生活和科研中应用十分广泛
(1)传统工业上利用氨气合成尿素
①以CO2与NH3为原料合成尿素的主要反应如下:
2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+ 72.49 kJ·mol-1
反应2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH= kJ·mol-1。
②液氨可以发生电离:2NH3(l) NH2- + NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式 。
NH2- + NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式 。
(2)氨气易液化,便于储运,可利用NH3作储氢材料
已知:2NH3(g) N2(g) + 3H2(g) ΔH=+92.4 kJ·mol-1
N2(g) + 3H2(g) ΔH=+92.4 kJ·mol-1
① 氨气自发分解的反应条件是 (填“低温” 或 “高温”)。
②其他条件相同,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度的变化如右图所示。

在600℃时催化效果最好的是 (填催化剂的化学式)。c点氨气的转化率高于b点,原因是 。
(3)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,把垃圾渗滤液加入到如图所示的电解池(电极为惰性材料)进行电解除去NH3,净化污水。该净化过程分两步:第一步电解产生氧化剂,第二步氧化剂氧化氨氮物质生成N2。

①写出电解时A极的电极反应式: 。
②写出第二步反应的化学方程式: 。
高锰酸钾(KMnO4)是一种常用的氧化剂。
I.(1)有下列变化: ,找出其中一个变化与“
,找出其中一个变化与“ ”组成一个反应,写出该反应的离子方程式____。
”组成一个反应,写出该反应的离子方程式____。
(2)不同条件下高锰酸钾可发生如下反应:
 由此可知,高锰酸根离子(MnO—4)反应后的产物与有关。
由此可知,高锰酸根离子(MnO—4)反应后的产物与有关。
(3)高锰酸钾溶液与硫化亚铁有如下反应:
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为个。
Ⅱ.酒后驾车已成为一个社会问题。检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种。
(4)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC: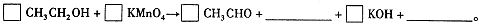
完成并配平上述反应。
(5)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,该反应的化学方程式为____。
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:。
(2)PO43—的空间构型是。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子中氮原子轨道的杂化类型是。
(4)胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有。(填序号)
a.离子键 b.极性键 c.金属键
d.配位键 e.氢键 f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为。 
一种含铝、锂、钴的电子废料中,铝以铝箔的形式存在,钴以Co3O4的形式存在(吸附在铝箔的单面或双面),锂混杂于其中。从该废料中回收Co3O4的工艺流程如下:
(1)溶液A的溶质的主要成分为。(填化学式)
(2)钴渣中加入稀H2SO4酸化后,再加入Na2S2O3溶液可以浸出钴离子,则浸出钴离子的离子方程式为(产物中只有一种酸根)。
(3)在实验室模拟工业生产时,也可用盐酸浸出钴离子,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴离子的主要原因:。
(4)加入NaF的反应为:Li++F- LiF↓,该反应的平衡常数表达式为K=。
LiF↓,该反应的平衡常数表达式为K=。
(5)加入30%Na2CO3溶液的作用是。
(6)在空气中锻烧CoCO3生成Co3O4的化学方程式是。
镓(Ga)、锗( Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端科学特别是信息领域有着广泛的用途。已知砷化镓的晶胞结构如图。试回答下列问题:
(1)下列说法不正确的是(选填序号)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.第一电离能:Se >As> Ge> Ga |
| C.镓、锗、砷、硒都属于p区元素 |
| D.半导体GaP、SiC与砷化镓为等电子体 |
(2)砷化镓是将(CH3)3Ga和AsH3反应制备得到,该反应在700℃进行,反应的方程式为,AsH3空间形状为 。
(3)Ge的核外电子排布式为 ,H2 Se中硒原子的杂化方式为。
(4)AsH3沸点比NH3低,其原因是:。
天然气、煤炭气(CO、H2)的研究在世界上相当普遍。其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势。主要反应为:
①CH3OCH3(g) +H2O(g) 2CH3OH(g)△H= 37Kj·mol-1
2CH3OH(g)△H= 37Kj·mol-1
②CH3OH(g)+H2O(g)  3 H2(g)+CO2(g)△H =49Kj·mol-1
3 H2(g)+CO2(g)△H =49Kj·mol-1
③CO2(g) +H2(g)  CO(g) +H2O(g)△H=41.3Kj·mol-1
CO(g) +H2O(g)△H=41.3Kj·mol-1
其中反应③是主要的副反应,产生的CO对燃料电池Pt电极有不利影响。
请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为。
(2)CH3OCH3(g)与水蒸气制氢气的热化学方程式为 。
(3)下列采取的措施和解释正确的是。(填字母序号)
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在高温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,虽然对制取氢气不利,但能减少CO的产生
(4)煤炭气在一定条件下可合成燃料电池的另一种重要原料甲醇,反应的化学方程式为:
CO (g) +2H2(g)  CH3OH(g)△H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(
CH3OH(g)△H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(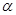 )与温度、压强的关系如下图所示。
)与温度、压强的关系如下图所示。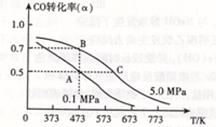
①自反应开始到达平衡状态所需的时间tAtB(填“大于”、“小于”或“等于”)。
②A、C两点的平衡常数KAKC(填“大于”、“小于”或“等于”)。
(5)某工作温度为650oC的熔融盐燃料电池,是以镍合金为电极材料,负极通人煤炭气(CO、H2),正极通人空气与CO2的混合气体,用一定比例的Li2CO3和Na2CO3混合物做电解质。请写出正极的电极反应式____。