食醋(主要成分CH3COOH)、纯碱(Na2CO3)和小苏打(NaHCO3)均为家庭厨房中常用的物质。已知:
| 弱酸 |
CH3COOH |
H2CO3 |
HNO2 |
| 电离常数 |
K=1.8×10-5 |
K=4.3×10-7 K=5.6×10-11 |
K=5.0×10-4 |
请回答下列问题:
(1)25℃时,0.10mol•L-1Na2CO3溶液的pH=11,则溶液中由水电离出的c(OH-)____________;
(2)常温下,将20mL 0.10mol•L-1CH3COOH溶液和20mL 0.10mol•L-1HNO2溶液分别与20mL 0.10mol•L-1NaHCO3溶液混合(混合后溶液体积变化忽略不计)。
①反应开始时,v(CH3COOH )______ v(HNO2)(填“>”、“<”或“:”),原因是____________;
②充分反应后.两溶液中c(CH3COO-)______ c(NO2-)(填“>”、“<”或“=”)。
(3)25°C时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中 =_____;
=_____;
(4)常温下,下列方法可以使0.1mol·L-1CH3COOH的电离程度增大的是
a.加入少量的稀盐酸 b.加热溶液 c.加水稀释 d.加入少量冰醋酸
(5)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是________。
①因醋酸是弱酸,故反应可进行 ②醋酸铅是弱电解质 ③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是(用化学式表示):;写出C与A形成的18e-化合物的电子式;
(3)用电子式表示A2C的形成过程:
(4)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:
____________________________________________________;
写出题中生成M的化学方程式
(5)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则负极上的电极反应式为__________________________,若标准状况下,正极消耗3.36L气体,则通过外电路的电子是个。
(1)在原子序数为 1 — 18 号的元素中, 用适当的化学符号填写下列空白(稀有气体除外):
原子半径最大的是 ______;氧化性最强的单质是 _____;
酸性最强的含氧酸是 ________;属于两性氢氧化物的物质是______;
最稳定的气态氢化物;表示含有8个质子,10个中子的原子的化学符号。
(2)苯环结构中不存在C-C单键与C=C双键的交替结构,可以作为证据的是
①苯不能使溴水褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等,都是1.40×10-10m
某有机化合物A能发 生如下图所示转化:
生如下图所示转化:
请回答:
(1)对上述反应或物质的下列说法正确的是(填序号):
①物质A、B、C、D、F都是芳香化合物; ②物质D是一种环状醇,与乙醇是同系物;
②物质D是一种环状醇,与乙醇是同系物;
③物质F能使溴水和酸性高锰酸钾褪色;
④六种物质都能与金属钠反应放出氢气;
⑤上图转化涉及氧化、加成、消去、取代四种反应类型;
⑥A、B、F都在催化剂和加热条件下与氢气发生加成反应。
(2)物质A存在的官能团名称为,其化学式为。
(3)F与溴水反应的生成物的结构简式为;
A与金属钠反应的化学方程式为。
(4)物质C与D反应生成E化学方程式为。
A、B、C、D、E五种短周期元素的原子序数依次增大。元素A的负一价离子具有和稀有气体He一样的结构,元素B的最外层电子数是内层电子总数的2倍,元素C是短周期元素中原子半径最大的主族元素,元素D在地壳中的含量位于第二位,元素E与元素B可形成具有正四面体结构的物质。请回答下列问题:
(1)在周期表中,元素B位于周期族;A与C形成的离子化合物的电子式为;A与C形成的离子化合物与水反应的化学方程式为。
(2)C、E形成的简单离子的离子半径大小关系为(用离子符号表示)。
(3)D、E元素形成的化合物可与水反应生成一种沉淀和一种气体,试写出该反应的化学方程式:。
(4)单质B与水反应是将B充分利用的措施之一,试写出该反应的化学方程式:
。
如图甲所示,某同学将一小块钠放在石棉网上加热,观察到生成的产物除了淡黄色固体外还有一些黑色固体物质,当时他想这种黑色物质应该是钠表面吸附的煤油不完全燃烧产生的碳单质,但在学习了镁与C02的反应后,该同学想:就金属活动性而言,Na比Mg还强,该黑色物质是否是Na与C02反应生成的碳单质。为了验证自己的想法,该同学利用装置乙进行实验。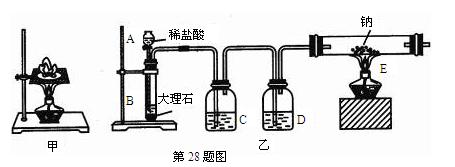
实验步骤如下:①切取一小块金属钠,用滤纸完全吸干煤油,再除去表面的氧化层,放进干燥的E中;
②打开分液漏斗的活塞,使B中的反应进行一段时间后,再点燃E处的酒精灯。
实验现象如下:钠在充满C02气体的玻璃管中剧烈燃烧起来,产生大量的白烟;玻璃管中有黑色物质生成;待玻璃管冷却后,管壁上附着一层白色物质。
请回答下列问题:
(1)C中盛放的试剂是,作用是。D中盛放的试剂是,作用是。
(2)B中的反应进行一段时间后,再点燃E处的酒精灯的目的是。
(3)该同学将白色物质和黑色物质分别溶于水,发现黑色物质不溶于水,白色物质能溶于水。由此,该同学得出结论,该黑色物质是Na与C02反应生成的碳单质,则其他生成物还应该有。
(4)请设计一实验方案验证玻璃管内Na与C02反应生成的白色物质的成分,并写出实验步骤、现象和结论。
(5)若先点燃E处的酒精灯,再打开分液漏斗的活塞,写出此时玻璃管E中可能发生的反应的化学方程式。