人体血液里存在重要的酸碱平衡:CO2+H2O H2CO3
H2CO3 HCO3-+ H+,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-+ H+,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
| c(HCO3-) ∶c(H2CO3) |
1.0 |
17.8 |
20.0 |
22.4 |
| pH |
6.10 |
7.35 |
7.40 |
7.45 |
试回答:
①正常人体血液中,HCO3-的水解程度________电离程度(填“大于”、“小于”、“等于”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③ pH=7.00的血液中,c(H2CO3)________c(HCO3-) (填“<”、“>”、“=”)
④等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为____________________。
(2) ①已知25 ℃时, CO32-水解反应的平衡常数(即水解常数)Kh= =2×10-4 mol·L-1,则HCO3-的电离平衡常数是Ka2=________,当溶液中c(HCO3-)︰c( CO32-)=2︰1时,溶液的pH=________;
=2×10-4 mol·L-1,则HCO3-的电离平衡常数是Ka2=________,当溶液中c(HCO3-)︰c( CO32-)=2︰1时,溶液的pH=________;
②0.1 mol·L-1 Na2CO3溶液中c(OH-)-c(H+)=________[用 c(HCO)、 c(H2CO3)的关系式表示]。
(B)(8分)下表中有甲、乙两组物质,可用编号回答下列问题:
| 甲 组 |
(A)C6H5OH (B)CH3COOCH3 (C)CH3=CHCOOH (D)CH3CH2Br |
| 乙 组 |
①溴水 ②FeCl3溶液 ③NaOH溶液 ④HCHO溶液 |
(1)甲组中B只能和乙组中发生反应。
(2)甲组中和乙组中②可以发生显色反应,此反应可用于两种物质的相互检验。
(3)甲组中能与乙组中所有物质发生反应。
(4)乙组中①能与甲组中发生取代反应,发生加成反应。
(5)甲组中的一种物质和乙组中的一种物质可以发生缩聚反应生成一种粉红色线型高分子化合物,该反应的方程式为。
(A)(8分)元素周期表是学习化学的工具,也为化学的进一步探索与研究提供了理论指导,化学学习者和研究者一直关注周期表的运用与发展。试回答下列问题:
(1)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素。你由此可知最先产生的元素是(填写元素符号)。
(2)1906年的诺贝尔化学奖授予为制备F2单质作出重大贡献的化学家莫瓦桑,你认为最先用来与F2反应制备稀有气体化合物的元素是(填写元素符号)。
(3)2006年11月16日美国和俄罗斯科学家联合宣布,他们合成出了118号元素,新原子的质量数为297,则该新原子中子数与质子数之差为。
(4)人们研究发现第一周期与第二周期一些元素的性质与同族元素性质共性很少,有人建议将氢放在VIIA,写出一种能支持该观点的化合物:;人们发现Li+溶剂化倾向很强,提出类似于氢键的“锂键”,请画出(LiF)2含锂键的结构式:。
(5)研究周期表发现存在对角线规则,处于对角线上的元素性质相似,如硼与硅处于对角线,请写出硼和氢氧化钠溶液反应的离子方程式:。
【化学–选修3:物质结构与性质】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是(填元素符号,下同),电负性最大的是。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式,1 mol AB-中含有π键的数目为,黄血盐晶体中各种微粒间的作用力不涉及(填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.分子间的作用力
(3)E2+的价层电子排布图为,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③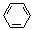 、④HCHO。其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)。
、④HCHO。其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F 两种晶体晶胞中金属原子的配位数之比为。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为。
[化学——选修3]物质结构与性质:(15分)有A、B、C、D、E五种元素。其相关信息如下:
请回答下列问题。
(1)写出E元素原子基态时M层的电子排布式。
(2)C元素单质分子中含有δ和∏键的键数之比为。
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是::C2A4分子中c原子轨 道的杂化类型是。
(4)A、C、E三种元素可形成:【E(CA3)4】2+配离子,其中存在的化学键类型有(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E(CA3)4】2+具有对称的空间构型.且当【E(CA3)4】2+中的两个CA3分子被两个Cl一取代时.能得到两种不同结构的产物,则【E(CA3)4】2+的空间构型为(填序号)。
a.平面正方形 b.正四面体c.三角锥型d.V型
(5)B与D可形成离子化合物.其晶胞结构如图所示。其中D离子的配位数为.若该晶体的密度为a g·cm-3,则该晶胞中距离最近的B和D之间的距离是cm(写出表达式即可,NA代表阿伏加得罗常数)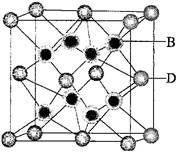
【化学选修3-物质结构与性质】(15分)a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
| a |
原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| b |
基基态原子的P轨道电子数比s轨道电子数少1 |
| c |
在周期表所列元素中电负性最大 |
| d |
位于周期表中第4纵行 |
| e |
基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种_________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm ,则晶胞的体积为________(
,则晶胞的体积为________(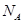 用表示阿伏加德罗常数的值)。
用表示阿伏加德罗常数的值)。