某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电离率。
饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%
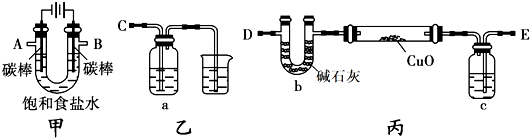
甲方案:利用甲、乙装置测定饱和食盐水的电解率
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的U形管左端的实验现象为________________; 该电解池总反应的化学方程式为________________;
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为__________连_________(填A、B、C、D、E等导管口),则洗气瓶a中发生反应的离子方程式为________________;
乙方案:利用甲、丙装置测定饱和食盐水的电解率
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率。
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则 该干燥装置应与__________口连接(填A、B、C、D、E等导管口)。
②另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?________(填“同意”或“不同意”)请说明理由 ________________________。
丙方案:只利用甲装置测定饱和食盐水的电解率
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,求饱和食盐水的电解率__________(保留一位小数,假设电解前后溶液体积不变,饱和食盐水密度约为1.33g/mL,溶解度为36.0g)。
芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:
反应试剂、产物的物理常数:
| 名称 |
相对分子质量 |
性状 |
熔点 |
沸点 |
密度 |
溶解度 |
||
| 水 |
乙醇 |
乙醚 |
||||||
| 甲苯 |
92 |
无色液体易燃易挥发 |
-95 |
110.6 |
0.8669 |
不溶 |
易溶 |
易溶 |
| 苯甲酸 |
122 |
白色片状或针状晶体 |
122.4 |
248 |
1.2659 |
微溶 |
易溶 |
易溶 |
主要实验装置和流程如下:
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
(1)无色液体A的结构简式为 。操作Ⅱ为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是 。
(3)下列关于仪器的组装或者使用正确的是 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入 ,分液,水层再加入 ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为 。
【改编】某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水。与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+
甲同学设计的实验方案如下:
(1)方案中试剂M是 ;沉淀A是 。
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(3)若金属中含铝,则沉淀 (选填沉淀编号)的质量不为零;若金属中含锌,则沉淀 (选填沉淀编号)的质量不为零。若沉淀B、C的质量均不为零,则生成B的离子方程式为: 。
(4)乙同学对甲同学的方案做了如下改进:
沉淀D为 ,与甲同学的方案相比,此方案的优点 。
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是 。
(6)上题中当沉淀质量最大时,溶液呈 (从下列选项中选填,下同);当沉淀只有一种成分时,溶液可能呈 。
A.酸性B.中性
C.碱性 D.可能酸性,也可能碱性
水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂。实验室制备水杨酸甲酯装置示意图和有关数据如下:
反应原理:
实验步骤:
①在干燥的三颈烧瓶中入7.0g水杨酸、30mL(0.64moL)甲醇、3mL浓H2SO4和2~3片碎瓷片,在85~95 ℃下加热回流(如图甲);
②1.5h后将回流装置改为蒸馏装置,水浴加热(如图乙);
③余下的反应液冷却至室温,依次用水、碳酸钠溶液和水洗涤,后再分离(如图丙);
④分出的产物加入少量无水CaCl2固体,静置片刻后过滤,
⑤对滤液蒸馏纯化,收集221~224℃馏分,得水杨酸甲酯6.1g。
⑥其它量不变,改用2mL浓H2SO4重复上述操作,得水杨酸甲酯5.5g.
回答下列问题:
(1)甲中所用三颈烧瓶应选用 ,
| A.100mL | B.150mL | C.250mL | D.500mL |
(2)整个实验两次用到蒸馏装置,第一次用蒸馏装置的目的是: 。
(3)步骤③中所用到的玻璃仪器的名称是 ;
(4)本实验甲醇要过量,其目的是 ,
(5)步骤③要进行两次水洗,如果没有进行第二次水洗,可能的后果是 。
(6)浓H2SO4的用量为3mL时,水杨酸甲酯的产率是 ,
(7)该实验中,浓硫酸主要表现了 性质。
【改编】研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 |
离子半径(pm) |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
74 |
7.6 |
9.7 |
| Fe3+ |
64 |
2.7 |
3.7 |
| Al3+ |
50 |
3.8 |
4.7 |
| Mn2+ |
80 |
8.3 |
9.8 |
| Pb2+ |
121 |
8.0 |
8.8 |
| Ca2+ |
99 |
- |
- |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的离子方程式 。
(2)氧化过程中主要反应的离子方程式为: ,氧化的目的为: 。
(3)在氧化后的液体中加入 ,用于调节pH值,应调节pH的范围为 ,除去的主要离子为: ,吸附步骤除去的主要离子为 。
(4)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥50~60min,称量。
请回答以下问题:
(l)仪器a的名称是 ;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因: 。
(3)步骤③中不能将溶液蒸发至干的原因是 ;晶膜通常在溶液表面出现的原因是 。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是 。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 |
1 |
2 |
3 |
| Na2S2O3溶液体积(mL) |
19.98 |
20.02 |
21.18 |
则该产品的纯度是____ ,间接碘量法滴定过程中可能造成实验结果偏低的是____ 。
A.滴定管末用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡