材料是为人类社会所需要并能用于制造有用器物的物质。按用途可分为结构材料,功能
材料等;按化学组成和特性又可分成四类,请将下列物质的标号填在相应的空格中:
A 水泥 B 半导体材料 C 塑料 D 超硬耐高温材料 E 陶瓷
F 普通合金 G 合成橡胶合成纤维 H 玻璃
(1)属于传统无机非金属材料的有______________________________;
(2)属于新型无机非金属材料的有______________________________;
(3)属于金属材料的有________________________________________。
工业制CuSO4时,不是直接用铜跟浓硫酸在加热条件下反应,而是将铜丝浸入稀硫酸中,再不断由容器下部吹入细小的空气泡。这样做的好处是。
在二氧化碳中混有少量的二氧化硫、三氧化硫、氯化氢杂质。设计一种一步只除去一种杂质,最后得到干燥纯净二氧化碳的实验方案。试回答:
(1)使气体经过各试剂(自选)的顺序为______________;
(2)写出有关的离子方程式:______________。
A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如右图:
请填写下列空白:
(1)物质A是,B是,C是。
(2)F中加入NaOH溶液,并在空气中放置的化学方程式是,。
(1)一个体重50kg的健康人含Fe元素约2g。主要以Fe2+、Fe3+形式存在于人体内。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vitc,可使食物中的Fe3+转化为Fe2+。
①人体中经常进行Fe2+ Fe3+的转化,在过程A中,Fe2+做剂,过程B中Fe3+做剂。
Fe3+的转化,在过程A中,Fe2+做剂,过程B中Fe3+做剂。
②Vitc使Fe3+转化为Fe2+,Vitc在这一过程中做,具有性。
(2)写出下列反应的化学方程式,并注明氧化剂、还原剂
①“曾青得铁化为铜”:;
②用CO还原Fe2O3炼铁:。
有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有___________________(选填序号)。
①加成反应②酯化反应③加聚反应④氧化反应
(2)B分子所含官能团的名称是_____________、_____________。
(3)B分子中没有支链,其结构简式是__________________________,B的具有相同官能团的同分异构体的结构简式是__________________________。
(4)由B制取A的化学方程式是________________________________________________。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:
B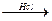 C
C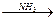 天门冬氨酸
天门冬氨酸
天门冬氨酸的结构简式是________________________。