草酸存在于自然界的植物中。草酸晶体(H 2C 2O 4•2H 2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。草酸能与氢氧化钙反应生成沉淀:H 2C 2O 4+Ca(OH) 2=CaC 2O 4↓+2H 2O.请回答下列问题:
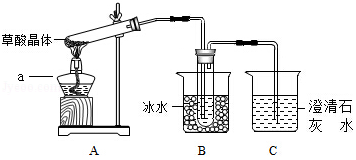
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,仪器a的名称是 。装置B的主要作用是 。装置C中有气泡逸出,澄清石灰水变浑浊,由此可知草酸晶体分解的产物中一定有 。
(2)乙组同学认为草酸晶体分解的产物中还有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置依次连接的合理顺序为:A→B→( )←( )→( )→I→D→H。
②装置I中盛有的氧化铁发生了颜色变化,欲证明草酸晶体分解的产物中有CO,乙组同学需要两次使用装置D,其现象分别是 。
铝是重要的轻金属,广泛应用于航空、电讯和建筑领域。铝亦有其特殊的性质,试根据以下信息填空或简答。
(1)按金属的活动性顺序,铝比锌 。但是将铝片和锌粒分别投入稀硫酸中,铝片表面产生的气泡却比锌粒少而慢。为了探究铝与酸反应的规律,小强用相同质量、相同形状的光亮铝片设计如下实验。
|
实验一 |
实验二 |
实验三 |
实验四 |
|
|
实验现象 |
铝表面产生气泡很小且慢 |
铝表面产生大量气泡 |
铝表面产生大量气泡 |
铝表面产生大量气泡且快 |
(2)比较实验三、实验四说明铝与酸反应产生氢气的速率,与 有关。
(3)比较实验一、实验二说明铝与酸反应产生氢气的速率,可能与 、 粒子和温度、金属与酸的接触面积等多种因素有关。
(4)写出实验二中发生反应的化学方程式 。
(5)小芳将长条状铝片的一端放在酒精灯火焰上灼烧片刻,轻轻摇动铝条,受热一段会左右摇晃,却不像蜡烛那样滴落。为探究其原因,小芳查阅资料得知:铝的熔、沸点分别是660℃、2460℃;氧化铝的熔、沸点分别为2054℃、2980℃。
试解释上述实验现象: 。
根据如图回答问题。

(1)仪器①的名称是 。
(2)实验室用氯酸钾制取氧气的化学方程式为 。所选用的收集装置是E或 (填字母序号,下同)。
(3)实验室用大理石和稀盐酸制取二氧化碳,所选用的发生装置是 。收集一瓶二氧化碳,将燃着的木条放在瓶口,若观察到 ,说明瓶中已充满二氧化碳。
(4)某同学用较浓的盐酸制取氢气,若要制取并收集一瓶较纯净的氢气,则装制连接顺序序号为 。
(5)实验室制取2g氢气,理论上应取锌的质量是 g。
现有一包黑色粉末,可能由铁粉、碳粉和氧化铜中的一种或几种物质组成。某化学兴趣小组对黑色粉末的成分进行探究并提炼其中的某种金属。
【提出问题】黑色粉末是什么?
【初步实验】把少许黑色粉末与足量稀盐酸混合,立即产生气泡,且反应后无固体剩余。
【查阅资料】①常温下碳的化学性质不活泼,不与稀盐酸发生反应。
②氢气具有还原性,可用于冶金工业。
【初步结论】黑色粉末可能是 或 。
同学们为了进一步确定黑色粉末的成分,进行了如下实验。
【设计实验】如图所示实验
【实验现象】试管底部有红色物质生成。
【实验结论】黑色粉末是 ,试管中发生反应的化学方程式为 。
【拓展探究】为了提炼其中的某种金属,同学们取相同质量的黑色粉末,设计了如下两种实验方案:

(1)步骤2和步骤3中物质分离的操作名称是 。
(2)方案中的五个步骤,其中不能说明铁的活动性比铜强的步骤是 。方案中属于复分解反应的化学方程式为 。
(3)D、E是同一种溶质形成的溶液,但不能判断其中溶质质量大小,理由是 。
(4)请你分析哪种方案合理并说明理由 。

某实验小组的同学用氢氧化钠溶液和盐酸做中和反应的实验,当他们向盛有氢氧化钠溶液的烧杯中滴加一定量的稀盐酸后,发现忘记了滴加指示剂。他们停止滴加稀盐酸,对烧杯内溶液中的溶质成分进行探究。
(1)写出该中和反应的化学方程式: 。
(2)探究烧杯内溶液中的溶质的成分。
【猜想】猜想一:可能是NaCl和NaOH;猜想二:可能只有NaCl;猜想三: 。
【进行实验】
|
实验步骤 |
实验操作 |
实验现象 |
结论 |
|
① |
取少量烧杯内的溶液于试管中,滴入几滴酚酞试液,振荡 |
|
猜想一不成立 |
|
② |
取少量烧杯内的溶液于另一支试管中,滴加碳酸钠溶液 |
|
猜想三成立 |
为加深对一氧化碳还原性的理解,减少一氧化碳对环境的污染,某同学设计了如图所示的实验。回答下列问题:
(1)图B中,薄铜片受热时发生反应的化学方程式为 。
(2)趁热将图B所示的薄铜片插入到图A所示的装置中(如图C所示),观察簿铜片的颜色变化。现象是 ;振荡集气瓶,观察到的现象是 。
(3)实验结束后用燃着的木条点燃瓶中的剩余气体,有明显的蓝色火焰出现,该反应的化学方程式为 。
