某化学小组的同学用锌粒与如图1中的硫酸溶液(部分标签被腐蚀)反应时,发现有气泡产生,并闻到有刺激性气味,他们对此气体的成分进行了探究。
[提出问题]锌粒加入硫酸溶液反应生成的气体是什么?
[查阅资料]
①浓硫酸也可以与锌粒发生反应,但不会生成氢气,也不会生成氧气,能生成二氧化硫气体。
②二氧化硫有刺激性气味,易溶于水,能使品红(一种红色素)溶液褪色。
③浓硫酸有吸水性,常用作干燥剂
④氢氧化钠溶液可吸收二氧化硫,并生成亚硫酸钠(Na2SO3)和水
[提出猜想]
甲同学认为:气体可能是H2;
乙同学认为:气体可能是SO2;
丙同学认为:气体还可能是 。
[实验探究]为了验证上述猜想,同学们在老师的指导下设计了如图2的装置(部分夹持器材略去,假设每个能发生的反应都能完全进行)进行探究:
(1)图中a仪器的名称是 ,D处气体发生装置,可选图中的 (填字母序号)
(2)实验开始后,观察到E中品红溶液褪色,证明气体中含有 。
(3)H装置的作用是 ,写出发生反应的化学方程式 。
(4)G装置加热一段时间后,观察到的现象是 ,证明气体中含有氢气。
[实验结论] 同学的猜想是正确的。
[反思与交流]
(5)锌与浓硫酸反应生成硫酸锌、水和二氧化硫,为何反应过程中又产生氢气了呢?用文字简述原因 。
(6)锌与浓硫酸、稀硫酸反应都可以生成硫酸锌,如果需要制取硫酸锌,往往选用锌与稀硫酸反应,其优点是 (答案合理即可)

某实验小组的甲、乙两同学围绕Na2CO3进行了如图一所示的实验。实验结束后,丙同学把A、B两支试管中的物质倒入同一洁净的烧杯中(如图二),充分混合后发现白色沉淀明显增加。

(1)甲同学的实验完成后,A试管一定有剩余的物质是 。
(2)乙同学的实验发生的化学方程式是 。
小组同学将C中液体过滤后,对所得滤液的主要成分进行了如下探究:
【猜想与假设】实验小组的同学对滤液的成分作出了如下猜想:
猜想一:滤液中的溶质是NaCl、Na2CO3
猜想二:滤液中的溶质是NaCl、CaCl2
猜想三:滤液中的溶质是NaCl、CaCl2、HCl
猜想四:滤液中的溶质是NaCl
【讨论与交流】通过认真讨论,小组同学排除了其中一种不合理的猜想。
(3)你认为不合理的猜想是 ,理由是 。
【进行实验】丁同学取少量滤液置于试管中,向试管中滴加一种物质,发现有无色气泡生成。
(4)你认为丁同学向滤液中滴加的物质是 。
【实验结论】通过探究,小组同学得出了猜想一是正确的结论。
实验室利用下列装置制取并收集O2(试管中的棉花根据反应的需要选择是否添加)。
(1)若要顺利制得O2,除选择KClO3与MnO2混合物作为药品外,还可以选择的药品是 (填化学式)
(2)如果选择KClO3与MnO2混合物作为制备O2的药品,则反应后MnO2的质量将 (填“增加”、“减小”或“不变”等)
(3)简述检查该装置气密性的方法 。
海水中蕴藏着丰富的资源,海水“晒盐”过程中可得到粗盐和卤水.粗盐中常含有多种杂质,必须对其分离和提纯,才能用于生产和生活;卤水经常用作工业制镁的原料.
(1)实验室除去粗盐中不溶性杂质的实验步骤为:溶解、过滤、蒸发结晶.在三步中都要用到的一种玻璃仪器是 .
(2)若要除去食盐固体中含有的少量CaCl2杂质,得到较为纯净的食盐晶体.请简述实验操作步骤: .
(3)在一烧杯中盛有Mg(OH)2和MgCl2的混合粉末6g,向其中加入20g水,经充分溶解后,再逐滴加入溶质质量分数为10%的稀盐酸.烧杯中溶液的溶液的总质量与加入稀盐酸的质量关系如图所示,请回答下列问题:
①当滴入稀盐酸30g时(即图中A点时),烧杯内溶液中的溶质是 (填写化学式).
②当滴入稀盐酸73g时(即图中B点时),试通过计算,求此温度时所得不饱和溶液中溶质的质量(计算结果精确至0.1g).

已知某固体样品A可能是NH4NO3和MgCO3或两者之一,另有一固体样品B,其中可能含有Na2SO4,BaCl2,CuSO4、KCl四种物质中的一种或多种.按如图所示进行探究实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应).
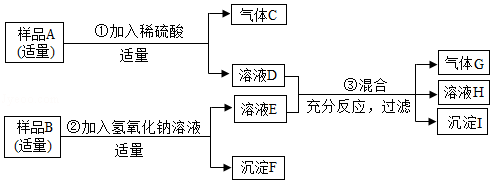
试根据实验过程和发生的现象,填写以下空白:
(1)将气体C通入紫色石蕊试液,试液变 色.
(2)沉淀F的化学式为 .
(3)溶液D中,一定存在的阳离子是 (填写离子符号).
(4)写出步骤③中生成沉淀I的化学方程式 .
(5)在溶液H中,肯定存在的阴离子有 种.
(6)固体样品B中,一定不存在的物质是 (填写化学式),得出此结论的理由是: .
如图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各化学实验。

(1)以过氧化氢溶液为原料(二氧化锰作催化剂),在实验室中制备并收集干燥的氧气。按照要求设计实验装置,连接仪器,并检验装置的气密性。
①所选装置的连接顺序为 (从左至右填写装置序号字母)。
②制取氧气所发生反应的化学方程式为 。
③下列有关氧气制取和性质的叙述中,不正确的是 (填写序号A、B、C,D之一)
A.实验室制氧气时,应先加入药品,再检査装置的气密性
B.在此反应前后,二氧化锰的质量和化学性质都不发生改变
C.铁丝在纯氧中剧烈燃烧时,火星四射,生成黑色固体
D.氧气是一种化学性质比较活泼的气体
(2)用干燥纯净的氧气对纤维素的组成进行分析探究实验(资料显示纤维素只含C、H、O三种元素)。所选装置按"氧气→D→A→C→碱石灰干燥管"的顺序连接(实验前检验装置的气密性,假设所发生的化学反应都完全充分进行)。装置D的玻璃管中放入纤维素试样的质量为wg,充分反应后,测得装置A的质量增加ag,装置C的质量增加bg,则纤维素中碳元素的质量分数为 (计算结果用含字母的代数式表示)。
若实验中使用的氧气未干燥,这样测算出的纤维素中碳元素与氢元素的质量比与实际值比较将 (填"偏大""偏小""基本一致""无法确定"之一)
(3)用一氧化碳气体(含有少量二氧化碳和水蒸气)测定某铁的氧化物(Fe xO y)试样的元素组成比例,所选装置按"混合气体→A 1→D→C→A 2"的顺序连接(A 1、A 2为浓硫酸洗气瓶,实验前检验装置的气密性,假设所发生的化学反应都充分反应)。进行实验并记录实验数据,如下表所示:
|
装置编号 |
A 1中浓硫酸 |
D中玻璃管内固体 |
C中溶液 |
|
反应前质量 |
150g |
14.4g |
200g |
|
反应后质量 |
152.7g |
11.2g |
213.2g |
①请选择合理数据计算Fe xO y中x:y= (填写最简整数比)。
②从环保角度考虑,该实验方案设计还存在不完善之处,你的具体改进方案是 。