某混合气体中含有CO、CO2、SO2三种气体。某兴趣小组对此进行了探究。
[查阅资料]
Ⅰ.SO2能使品红溶液褪色,易与高锰酸钾溶液反应而被吸收,能与氢氧化钠溶液反应,能使澄清的石灰水变浑浊。
Ⅱ.CO和CO2均不能使品红溶液褪色,也不与高锰酸钾溶液反应。
Ⅲ.CO与CuO反应的化学方程式为:CO+CuO Cu+CO2。
Cu+CO2。
[实验探究]为验证这三种气体,同学们在老师指导下,设计并进行如下实验:
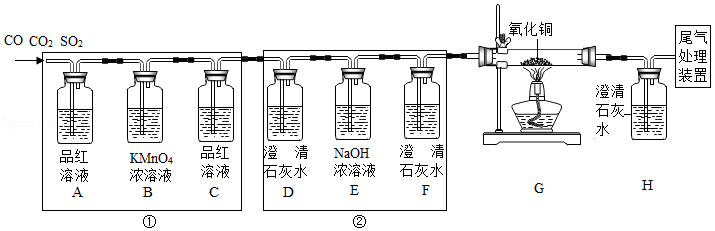
[事实与结论]通过实验验证了以上三种气体的存在,请完成下列空格:
(1)装置E的作用是 。
(2)能证明气体中含有SO2的现象是 ,含有CO2的现象是 。
[反思与评价]若将装置①和装置②互换,则无法验证的气体是 (填写化学式)。
某化学兴趣小组为探究碱和盐的化学性质,进行了如图1所示实验(忽略空气中CO2对本实验的影响)。请你参与并完成相关内容。
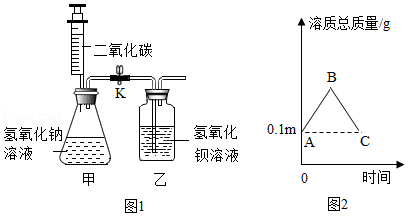
(1)步骤一:关闭K,向下缓慢推动注射器活塞并轻轻振荡锥形瓶,使二氧化碳全部进入锥形瓶,并与m克溶质质量分数为10%的NaOH溶液恰好完全反应转化为碳酸钠,反应的化学方程式为 ,轻轻振荡锥形瓶的目的是 。
步骤二:打开K,向上缓慢拉动注射器活塞,观察到乙中溶液进入甲。
(2)上述实验过程中,甲中溶质总质量变化情况如图2所示, B点对应的溶质总质量为 (用含m的代数式表示,可以不化简)克,BC段反应的化学方程式为 ,BC段溶质总质量下降的原因是 。
(3)步骤一和步骤二结束后,将甲和乙中的物质全部转移到烧杯中,搅拌后过滤,得到白色沉淀和滤液。结合图2中C点的值确定滤液中溶质的成分为 ,理由是 。
自然界并不缺少镁,缺少的是发现镁的眼睛。某化学兴趣小组开启寻镁之旅,现邀请你参与并完成相关内容。
(1)第一站:初识金属镁。①金属镁的物理性质: (写一条);②金属镁的化学性质:镁能与氧气反应,反应的化学方程式为 。
(2)第二站:再遇金属镁。将打磨过的镁条放入稀盐酸中,反应现象是 ,化学方程式为 。
(3)第三站:制备金属镁。小组同学模拟工业上从海水晒盐剩下的苦卤中提取镁,流程如下:
苦卤 Mg(OH)2 MgCl2 Mg,流程中X为 。
(4)第四站:再探金属镁。
[提出问题]镁能否与热水反应?如果反应,产物是什么?
[相关信息]①Mg+2H2O=Mg(OH)2+H2↑;②氢氧化镁在热水中能部分溶解。
|
实验操作 |
实验现象 |
实验结论 |
|
① ② |
① ② |
镁能与热水反应,生成氢氧化镁和氢气 |
(5)上述寻镁之旅中你收获到镁的化学性质有 。
溶液在日常生活、工农业生产和科学研究中具有广泛用途。
(1)KNO3属于复合肥,所含的营养元素有 ,溶质质量分数为3%的KNO3溶液常用作无土栽培的营养液,配制100g该营养液需要的溶质是 ,其质量为 g,配制时常用玻璃棒搅拌,目的是 。
(2)某KNO3固体(混有少量NaCl),要用它配制上述营养液,需在配制前进行提纯(图1为溶解度曲线),60℃时,KNO3的溶解度为 g,将该固体溶于水配制为接近饱和的溶液,可采用降温结晶的方法提纯KNO3,其理由是 。
(3)探究温度对溶解度的影响,如图2所示。固体X是NH4NO3或NaOH,固体Y是KNO3或Ca(OH)2,烧杯中盛放20℃Y的饱和溶液(有少量Y的固体剩余),往试管中滴入适量水,烧杯中固体逐渐消失,写出X与Y可能的组合 。

通过一年的化学学习,同学们初步掌握了实验室制取气体的知识和技能,请完成下列实验内容。

[制取气体]
|
实验名称 |
化学方程式 |
选用药品 |
制取气体 所选装置 |
|
实验室制取二氧化碳 |
|
石灰石和 稀盐酸 |
B C |
|
实验室制取氧气 |
|
|
|
[探究活动](1)通常将产生的二氧化碳通入装置F,目的是 。
(2)如果将产生的氧气通入装置G,现象是 。
[交流总结]如果实验室需要制取另一种气体,你的思路是 (不写具体操作)。
为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20g固体混合物置于烧杯中,将100g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
|
次序 |
① |
② |
③ |
④ |
|
加入稀硫酸的质量/g |
25 |
25 |
25 |
25 |
|
剩余固体的质量/g |
16 |
a |
10 |
10 |
回答下列问题:
(1)原固体混合物中,氧化铜的质量分数为 。
(2)上表中,a的值为 。
(3)计算该实验所用稀硫酸中溶质的质量分数。(写出计算过程,结果精确到0.1%)