化学课堂上,同学们在老师的指导下进行了分组实验。
【查阅资料】氯化钙溶液、氯化钠溶液都呈中性。
(1)第I组实验:探究酸和碱的反应。向试管中加入少量的氢氧化钙溶液,并滴入几滴无色酚酞溶液,充分振荡后,再逐滴滴入稀盐酸,并用玻璃棒不断搅拌,观察到溶液由红色变为无色,测得溶液的pH<7.该过程中发生反应的化学方程式为 ,反应后溶液中的溶质为 。
(2)第Ⅱ组实验:为了探究一瓶忘记盖瓶塞的氢氧化钠溶液中溶质的成分,同学们进行了如下实验。
[提出猜想]
猜想1;溶质是氢氧化钠;
猜想2:溶质是 ;
猜想3:溶质是碳酸钠。
[设计实验]
实验步骤 |
实验现象 |
实验结论 |
取少量样品于试管中,向其中加入适量的氯化钡溶液,充分反应后,过滤,向滤液中滴加几滴无色酚酞溶液 |
|
猜想3成立 发生反应的化学方程式为 。 |
[交流讨论]
老师问:“若向少量样品中,加入足量的稀盐酸,如果有气泡产生,猜想3一定成立吗?”同学们交流讨论后,一致认为猜想3不一定成立,原因是 。
(3)实验结束后,同学们将两组实验后的废液倒入同一个废液缸中进行集中处理。若使废液中只含有一种溶质氯化钠(酚酞除外)则需向废液中加入 。
2017年4月长春应用化学研究所提出了一种独特的锂﹣氮电池(LI﹣N2),结构示意图见左图,该电池由锂箔作负极,多孔碳布作正极,玻璃纤维作隔板,可以直接利用空气中的氮气,锂﹣氮电池的反应方程式:6Li+N2=2Li3N.请回答:
(1)氮气在空气中的含量约为
(2)Li3N中氮元素的化合价为
(3)锂原子的原子核内质子数为 ,它在化学反应中易 (填“得到”或“失去”)电子。
(4)玻璃纤维是玻璃熔融状态下抽成丝制得,它属于 (填序号)
A.无机非金属材料 B.金属材料 C.有机高分子材料
(5)碳布作为锂﹣氮电池的电极,是利用了碳单质的 (填一种物理性质即可)

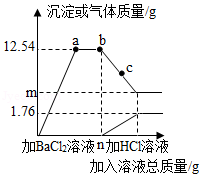
某环保小组监测到一造纸厂排放的废水中含有碳酸钠和硫酸钠两种物质,为测定废水中这两种物质的含量,环保小组的同学进行了以下实验:取该造纸厂排放的废水200g,先向其中加BaCl2溶液至ng后停止,然后再滴加稀盐酸,反应过程中加入溶液的质量与产生沉淀和气体的质量关系如图所示.
(假设废水中其它成分不参与反应;钡的相对原子质量为137)
请根据图象与数据分析计算:
(1)a、b、c三点对应的溶液中所含BaCl2的质量关系是 (用“>”、“<”或“=”表示).
(2)m值等于 .
(3)该废水中硫酸钠的溶质质量分数(写出计算过程).
某化学兴趣小组为了验证甲烷与水蒸气经高温催化反应得到的混合气体(以下简称“合成气”)中含有生成的氢气和一氧化碳,同时检验“合成气”中是否含有未反应完的甲烷和水蒸气,进行了如图所示的实验。
查阅资料知,氧化铁与氢气在高温条件下反应生成铁和水;氧化铁与甲烷在高温条件下反应生成铁、二氧化碳和水。
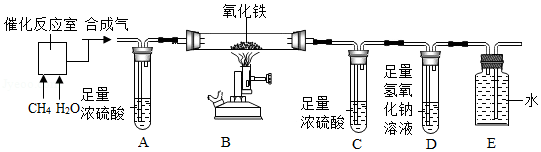
(1)请写出甲烷与水蒸气在高温催化条件下反应的化学方程式 。
(2)实验开始前要先通一会“合成气”,然后再点燃B处的酒精喷灯,目的是 。
(3)装置C和D的连接顺序颠倒,会影响实验操作,原因是 。
(4)实验结束后,测得装置A、C、D的质量均增加,其中装置C增加了3.6g,装置D增加了3.3g。假设加热时“合成气”在装置B中反应完全,则可推断出该“合成气”的组成物质为 (写化学式)。
(5)装置A与E在实验过程中的作用分别是 、 。
在今年化学实验操作考试“探究纯碱的性质”中,同学们做了如图所示的四组实验,并将A、B、C、D四支试管中的废液全部倒入一个干净的大烧杯中。考试结束后,某兴趣小组发现大烧杯底部有沉淀,上层溶液呈红色。为了探究上层溶液的成分,进行了以下实验。

[提出问题]大烧杯中的上层溶液中除了含有水和酚酞外,还含有哪些离子?(假设难溶物质、水和酚酞均不会解离出离子)
[猜想假设]小明认为上层溶液中一定含有Na+、CO32﹣、H+、Cl﹣、Ba2+、Ca2+、OH﹣七种离子,你认为上层溶液中含有的离子最多可能有几种,它们分别是 (填离子符号)。
[分析讨论](1)小红认为上层溶液中一定不含有H+,因为上层溶液呈红色。请你分析上层溶液中不含有H+的另外一个理由 。
(2)小李取一定量的上层溶液于试管中,滴加几滴稀盐酸,发现无气泡产生,认为上层溶液中一定不含有CO32﹣.小红认为他的结论不正确,原因是 。
[设计实验]为进一步确定上层溶液中是否含有CO32﹣,请你和小红一起参与下列探究:
|
实验操作 |
实验现象 |
实验结论 |
|
取大烧杯中上层溶液少许于一支试管中,滴加过量的BaCl2溶液,静置 |
①
②试管中的上层溶液仍是红色 |
①大烧杯中上层溶液中一定含有CO32﹣ ②同时还能得出大烧杯中的上层溶液中一定含有离子是 (填离子符号) |
[实验结论]大烧杯中的上层溶液中一定含有的离子是 (填离子符号)。
某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验。
[实验一](已知:白磷的着火点为40℃)
|
实验装置 |
实验步骤及现象 |
|
|
步骤Ⅰ.检验装置的气密性,气密性良好。 步骤Ⅱ.将盛有白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧。 步骤Ⅲ.向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧。 步骤Ⅳ.打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2.此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧。 |
(1)对比步骤Ⅱ和Ⅳ的现象可知,可燃物燃烧的条件之一是
(2)待装置冷却一段时间后,打开K2,如果观察到 ,说明空气中氧气的体积约占 .若实验测得空气中氧气的体积分数小于
.若实验测得空气中氧气的体积分数小于 ,原因可能是 (答一条即可)。
,原因可能是 (答一条即可)。
[实验二]用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量。若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气中氧气的含量,并说明理由 。[已知:铜能与空气中氧气、水、二氧化碳反应生成铜绿。化学方程式:2Cu+O2+H2O+CO2═Cu2(OH)2CO3]
