碳捕捉与封存技术
“碳捕捉与封存”是我国的一项先进技术(如图所示)。
我国能源消耗的70%来自于煤炭。每秒有100吨煤在燃烧,年消耗量超过30亿吨。如果任由煤炭资源在诸多领域利用,将对大气、河流、土地产生污染,温室效应增强。为实现节能减排、绿色环保,我国政府举全国之力,积极倡导并大力发展新的绿色经济。比如:电厂中的煤在极高的温度下充分燃烧,会产生大量CO2,每年的排放量大约1600万吨,达用“碳捕捉与封存”技术,这些CO2将不会进入大气。被封存的CO2有许多用途,如用于食品保鲜、气体肥料、冷藏食物、物品灭火等,以此来消除资源的巨大浪费。我国正以超世界一流的目光发展经济,完善环保体制。
阅读文本,完成下列任务:
(1)“碳捕捉与封存”技术有利于控制 的加剧。
(2)煤在极高的温度下充分燃烧,主要发生反应的化学方程式为 。
(3)将分离聚集的CO2压入地下的过程中,分子间隔会 。
(4)将CO2封入蓄水层中发生反应的化学方程式为 。
(5)被封存起来的CO2用于冷藏食物的原理是 。

为了保护生态环境,针对全球气候变化,中国政府向全球承诺,力争于2060年前实现“碳中和”。“碳中和”是指在一定时间内,使二氧化碳的排放总量与吸收总量平衡,实现“零排放”。实现“碳中和”通常可采取如下措施:
Ⅰ.碳减排:减少人类生产和生活中二氧化碳的排放量。
(1)下列做法不能实现“碳减排”的是 。
A.加高烟囱排放工业废气
B.推进新能源汽车使用
C.废弃物分类投放并回收利用
D.养成节约用水用电习惯
Ⅱ.碳吸收:①利用植物光合作用,这是自然界消耗二氧化碳的最重要途径;②利用“碳捕捉与封存技术”,即通过一定的方法,将工业生产中产生的 分离出来进行储存。在实际生产中,经常用 溶液来“捕捉” 流程如图所示(部分条件及物质未标出)。
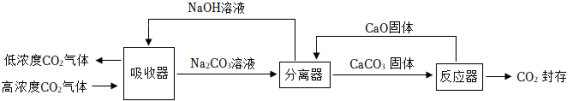
(2)用该技术进行“碳捕获”有效利用了原材料,该过程中被循环利用的物质有 。
(3)分离器中发生的反应:① ,② 。现有溶质质量分数为10.6%的 溶液100千克,求完全反应后,理论上可生成 的质量(要求根据化学方程式计算)。
Ⅲ.碳转化:指二氧化碳的资源化利用。
在化学实验中,经常需要对药品用量进行估算。既能确保实验成功,又能养成节约和环保的习惯。某化学兴趣小组为了体验估算方法,进行了如下实验:
【实验目的】对选定实验中所需药品用量进行估算并验证估算用量足够。

(1)【实验活动一】估算稀盐酸用量
①写出碳酸钙与稀盐酸反应的化学方程式: 。
②取2g石灰石样品进行实验(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶解于水),请估算,至少需要溶质质量分数为7.3%的稀盐酸 g。
(2)【实验活动二】验证估算的稀盐酸用量足够
方案一:
实验过程如图所示:
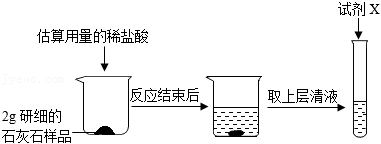
①将石灰石研细的目的是 。
②若图中试剂X为紫色石蕊试液,观察到的现象是 ,说明估算的稀盐酸用量足够。
③为达到与②相同的实验目的,试剂X还可以选择下列试剂中的 (填字母序号)。
| A. |
溶液 |
| B. |
溶液 |
| C. |
溶液 |
| D. |
|
方案二:
④只用以下两种规定用量的药品:2g石灰石样品和估算用量的稀盐酸,设计实验进行验证,请简述实验方案。(实验仪器任选)
|
实验操作 |
实验现象 |
实验结论 |
|
|
|
估算的稀盐酸用量足够 |
从宏观、微观、符号相结合的视角探究物质及其变化规律是化学独特的研究方法。根据所给信息,回答下列问题:
宏观辨识
(1)通过科学探究可以认识化学反应中各物质质量之间的关系,如图实验中,将 溶液滴入锥形瓶中,反应结束后,再次称量,观家到托盘天平的指针 (填“向左”“向右”或“不”)偏转。
微观探析
(2)如图是氢气在空气中燃烧的微观示意图,该反应的基本反应类型为 反应。从微观角度分析,过程I表示分子分解成 的过程。

符号表征
(3)氢化镁( )是一种很有发展前景的贮氢材料,能与水反应生成氢氧化镁和一种常见的气体,反应的化学方程式为: 。请补全该反应的化学方程式并写出补全依据。
依据一:化学反应前后原子的种类和 不变。
依据二: 。

化学是一门以实验为基础的自然科学
(一)实验帮助我们研究物质的组成
如图是测定空气中氧气体积分数的实验装置,请回答下列问题:

(1)红磷在空气中燃烧的现象是 ,发生反应的化学方程式为: 。
(2)实验结论:氧气约占空气总体积的 。
(二)实验帮助我们研究物质的性质

(3)图1实验中,食用油溶解于 中,该实验表明影响物质溶解性的因素是 。
(4)图2试管B中发生反应的化学方程式为: 。
(5)为了探究 、 、 的金属活动性顺序,图2试管C中需要补全的一组试剂是 。
(三)实验帮助我们研究物质的制法
实验室模拟炼铁原理的装置如图所示,请回答下列问题:

(6)写出A装置玻璃管中发生反应的化学方程式: ,该反应前后碳元素化合价发生的变化是 。
(7)B装置中的现象是 。
(8)实验中需要进行尾气处理的原因是 。
如图是实验室制取气体的常用装置,请回答下列问题:

(1)写出标号仪器的名称:① ,② 。
(2)实验室用高锰酸钾制取氧气,写出该反应的化学方程式: ,可选用的发生装置是 (填字母序号)。用F装置收集氧气,停止实验时,应先 ,再熄灭酒精灯。
(3)实验室用锌粒和稀硫酸制取氢气,可选用C装置作为发生装置,该装置的优点是 ,锌粒应该放在 。
(4)通常情况下,甲烷是一种无色、无味的气体,密度比空气小,难溶于水。实验室制取甲烷可选用的收集装置是 (填字母序号,写一种即可)。