某班同学取用相同总质量的木炭粉和氧化铜的混合物,按图示装置进行实验。实验过程中发现有的小组“黑色固体变红色”这一实验现象不明显。小组同学对此异常现象进行如下探究。
[知识回忆]碳和氧化铜反应的化学方程式为C+2CuO 2Cu+CO2↑,理论上碳和氧化铜的质量比为 。
[作出猜想]产生异常现象可能与所取用木炭粉和氧化铜的质量比有关。
[实验探究]小组同学用总质量相同但质量比不同的木炭粉和氧化铜的混合物(不考虑其中杂质),分别进行实验,部分实验现象记录如下:
实验序号 |
m(C):m(CuO) |
实验后A处试管中固体颜色 |
C处导管口的现象 |
1 |
1:8 |
红色固体中有少量黑色固体 |
尾气燃烧 |
2 |
1:9 |
红色固体中有较少量黑色固体 |
尾气燃烧 |
3 |
1:10 |
红色固体中有很少量黑色固体 |
尾气不燃烧 |
4 |
1:11 |
红色固体中有极少量黑色固体 |
|
5 |
1:12 |
红色固体中无黑色固体 |
尾气不燃烧 |
6 |
1:13 |
红色固体中有较多黑色固体 |
尾气不燃烧 |
[交流讨论]
(1)推测实验4中“C处导管口的现象”是 。
(2)上述探究可得出,实验时所用木炭粉和氧化铜的质量比控制在1:10~1:12之间,可观察到黑色固体明显变红,同时还可减少 (填化学式)排放,防止空气污染。
(3)检验实验6反应后A处试管中黑色固体物质,可滴加的试剂是 ,观察到的现象是 。
[反思评价]分析发现,实验5中m(C):m(CuO)比值与理论值不符,实验后却无黑色固体残留。请用化学方程式解释实验中过量的黑色固体消失的原因: (写一个即可)。

请根据如图回答问题。

(1)仪器①的名称是 。
(2)实验室用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式为 。若用图E装置收集氧气,当观察到导管口的气泡 时,再把导管口伸入盛满水的集气瓶。
(3)用收集的氧气完成木炭燃烧的实验(如图F所示),观察到的现象是 。
(4)通常状况下,甲烷是一种无色无味的气体,难溶于水,密度比空气小。实验室常用醋酸钠和碱石灰两种固体混合物加热制得甲烷气体。制取甲烷的发生装置可选用 (填字母,下同),收集装置可选用 。
请根据如图实验回答问题。

(1)图一为测定空气里氧气含量的实验。点燃红磷前,需要用弹簧夹夹紧胶皮管的原因是 。 该实验中不能用铁丝代替红磷的原因是 。
(2)图二为探究分子性质的实验。实验中观察到烧杯B中的液体由无色变为红色,说明分子具有的性质是 。
(3)图三为探究固体溶解时的热量变化实验,若向试管中加入的固体是NH4NO3,可观案到U形管内左侧液面 (填“低于”或“高于”)右侧液面。
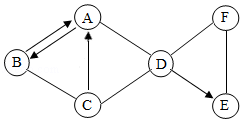
A﹣F为初中化学中常见的六种物质,其中A、B、C、D、E为五种不同类别的物质,A为大理石的主要成分,其相互反应及转化关系如图所示。(图中“﹣”表示相连的物质间能相互发生反应,“→”表示物质间有相应的转化关系,部分反应物、生成物及反应条件已略去)。请回答。
(1)C物质的一种用途是 。
(2)D→E的基本反应类型为 。
(3)B→A的化学方程式为: 。
(4)F的化学式可能是 。
金属材料广泛应用于生活和生产中。
(1)下列物品所用的主要材料属于金属材料的是 (填字母)。
A.瓷碗 B.玻璃瓶 C.一元硬币 D.硬铝门窗
(2)生铁和钢是使用最多的金属材料,二者性能不同的原因是 。 工业上采用赤铁矿石(主要成分为氧化铁)炼铁的反应原理是 (用化学方程式表示)。
(3)向Al(NO3)3、Cu(NO3)2、和AgNO3的混合溶液中加入一定量铁粉,待充分反应后过滤,向滤渣中加入稀盐酸。
①若有气泡产生,则滤液中的溶质是 ;
②若没有气泡产生,则滤液中溶质的组成最多有 种情况。
如图是某品牌的风味酸牛奶及每100g酸牛奶中主要营养成分数据。请回答下列问题。
|
营养成分 |
蛋白质 |
脂肪 |
糖类 |
钠 |
钙 |
|
质量 |
3.2g |
3.6g |
11.9g |
60mg |
80mg |
(1)人体必需的六大类基本营养素中,除水外,表中没有标示的营养素是 。
(2)表中能为人体提供能量的营养素有 种。
(3)该酸牛奶的外包装是一种塑料制品,随意丢弃会造成“白色污染”。为减少“白色污染”,可采取的措施是 (答一点)。
(4)酸牛奶中的蔗糖,在胃肠内转化为葡萄糖(C6H12O6)。葡萄糖在酶的催化作用下,与氧气反应生成水和二氧化碳,请写出该反应的化学方程式 。
