(1)某化学小组的同学对金属元素及金属材料进行系列研究。
①人类文明进步与金属材料的发展关系十分密切。常见的金属材料有铁合金、铜合金、铝合金,这三种合金被广泛应用的年代由远及近的正确排列顺序是下列选项中的 (填选项序号之一)。
| A. |
铜合金→铁合金→铝合金 |
| B. |
铁合金→铝合金→铜合金 |
| C. |
铝合金→铜合金→铁合金 |
②我国劳动人民很早就掌握了湿法冶金的技术,西汉的《淮南万毕术》、东汉的《神农本草经》都有用单质铁置换出铜盐中铜的记载,试写出用单质铁与 溶液反应进行湿法炼铜的化学方程式: 。
③黄铜是由铜和锌所组成的合金,其外观与黄金非常相似。将黄铜置于稀盐酸中,能观察到的明显现象是 (写出一条即可)。
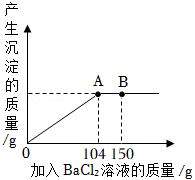
(2)现有 和 的固体混合物10g,将其全部放入一洁净的烧杯中,然后加入足量蒸馏水,搅拌,使固体完全溶解。再向烧杯中逐滴加入溶质质量分数为10%的 溶液,反应过程中产生沉淀的质量与所滴入 溶液的质量关系如图所示。试回答:
①当滴入 溶液150g时(即图中B点),烧杯中溶液里存在的酸根阴离子是 (填离子符号)。
②当滴入 溶液104g时(即图中A点),恰好完全反应,试通过计算,求10g该固体混合物中 的质量。(计算结果精确至0.1g)
【2015年山东省济南市】构建安全体系,建设小康社会,关系国计民生。近期,媒体报道的某些环境问题、卫生问题和安全问题引发了人们的关注:
(1)据报道:“济南俩月查处了13家‘铝包子’铺”,所谓‘铝包子’是指所用面粉中非法加入了含有硫酸铝铵[NH4Al(SO4)2.12H2O]成分的泡打粉,食物中铝元素超标,危害身体健康。在硫酸铝铵中,所含非金属元索共有__________种。
(2)露天烧烤不仅污染环境、导致周边空气中PM2.5指数严重超标,在烧烤的肉类食物中还含有强致癌物质一一苯并 (a) 芘(化学式为C2OH12),在苯并 (a) 芘中,氢元素与碳元素的原子个数之比为_________(填最筒整数比)。
(3)据报道:2015年5月6日在104国道某段,一辆载有20多吨浓硫酸的罐车不慎侧翻,造成大量硫酸泄漏。有关部门调来大量熟石灰粉[主要成分为Ca(OH)2]和沙土用于清除泄漏的硫酸。试写出硫酸和熟石灰反应的化学方程式:______________________________。
(4)世界卫生组织将5月3 1日定为“世界无烟日”,我国采取了公共场所禁止吸烟等控烟措施。吸烟有害健康,我国遭受二手烟危害的非吸烟人口就多达7.4亿。烟雾中主要含有一氧化碳、尼古丁(C10H14N2)和焦油,这三种物质被称为香烟的三大杀手。下列有关说法中,正确的是_________(填写序号A、B、C、D之一)
①生活中应拒绝毒品 ②焦油能诱发细胞病变 ③吸烟对他人无害
④“煤气”中毒是由一氧化碳引起的 ⑤在尼古丁中氮元素的含量最高
A.①④⑤ B.①②③ C.①②④ D.②③⑤
某地规定工业排放的废气中S0 2的含量不得超过0.4mg/L。某兴趣小组利用以下反应:S0 2+I 2+2H 20=H 2S0 4+2HI,测定某工业废气中S0 2的含量,测试装置如图所示。 
测试步骤:
①碘溶液的配制:准确称取l.27g碘单质,加入少量碘化钾,先溶解在100mL水中,继续加水配制成l000mL溶液。
②取5mL上述溶液,加入试管中,滴入2~3滴淀粉试液。
③把l00mL注射器的活塞推到底后,插入试管的橡皮塞中,如图所示。
然后缓缓向外拉,使吸入试管内的废气与淀粉碘溶液充分接触。每次抽取的气体为l00mL,重复抽取n次,直到溶液的颜色变为无色(废气中的其它成分不与淀粉碘溶液反应)。
(1)排放到空气中的S0 2气体主要来自于 燃烧。
(2)步骤②中,5mL溶液中溶有碘单质 mg,滴入淀粉试液后,溶液变为 色。
(3)按步骤测试某工业废气,抽取次数为80次后,溶液刚好变为无色。试计算该废气中S0 2含量,并判断是否符合排放标准。
根据下列装置图,回答有关问题: 
(1)写出装置图中标号仪器的名称:a____________;b____________。
(2)写出实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式:__________________________。可选用的收集装置是________(填字母)。
(3)写出实验室用石灰石和稀盐酸反应制取二氧化碳的化学方程式_________________________。可选用的发生装置是________(填字母)。
(4)实验室将A装置加以改动,在高温下使碳酸钙分解生成氧化钙和二氧化碳。按此反应,试计算工业上要制取5.6t氧化钙,理论上需要含碳酸钙80%的石灰石的质量是多少?(写出计算过程)
【2015年重庆市B】(学习化学后,我们学会了从微观角度认识物质。
(1)已知碳原子和氧原子的结构示意图分别为: 两种原子中相等的是 (填序号)。
两种原子中相等的是 (填序号)。
| A.质子数 | B.电子数 | C.第一层电子数 | D.第二层电子数 |
(2)保持一氧化碳化学性质的粒子名称是 。
(3)下图是一氧化碳与氧气反应的微观模型图,请在下图方框中以图示的方式完成该化学反应的微观过程(图中 表示氧原子,Ο表示碳原子)。
表示氧原子,Ο表示碳原子)。
【2015年广东省】“题图”为某化学反应的微观示意图。请回答:
(1)左方框图中的物质属于 (填“纯净物”或“混合物”)。
(2)此反应的化学方程式为 ,反应类型为 。