今有Ba(NO3)2、AgNO3、Fe(NO3)3的混合液,欲将Ba2+、Ag+、Fe3+
分离,分别得到三种元素的不溶物,按下图所示实验:
(1)加入的试剂(写化学式):X______,Y______,Z______。生成的沉淀(写化学式):A______,B______,C______。
(2)写出反应①②③的离子方程式:①____________,②____________,③____________。
Ⅰ.①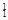 H与
H与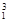 H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷
H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷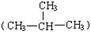 ;④甲烷(CH4)与丙烷(C3H8)。
;④甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是______ (填序号,下同)。
(2)互为同系物的是______。
(3)互为同分异构体的是______。
(4)互为同素异形体的是______。
II.A~E等几种烃分子的球棍模型如下图所示,据此回答下列问题。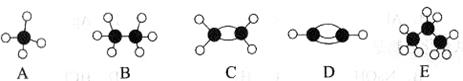
(1)D的电子式为___________,A的二氯取代物有种。
(2)可作为植物生长调节剂的是(填结构简式);
(3)A与氯气反应可以生成多种物质,试任写其中一个反应的化学方程式:;
(4)C与水在一定条件下反应的化学方程式为:。
Ⅰ.在一定条件下,xA+yB  zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向______移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为______。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g)  N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为2 L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。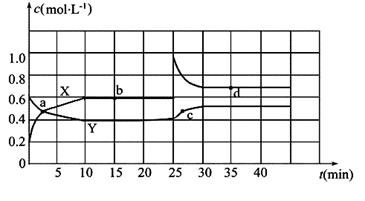
(1)图中共有两条曲线X和Y,其中曲线_______表示NO2浓度随时间的变化;a、b、c、d四个点中,
表示化学反应处于平衡状态的点是__________。
(2)①前10 min内用NO2表示的化学反应速率v(NO2)=_______mol·L-1·min-1。
②0~15 min ,反应2NO2(g)  N2O4(g)的平衡常数Kb=_______。
N2O4(g)的平衡常数Kb=_______。
③25 min~35 min时,反应2NO2(g)  N2O4(g)的平衡常数Kd_____Kb(填“>”、“=”或“<”)。
N2O4(g)的平衡常数Kd_____Kb(填“>”、“=”或“<”)。
(3)反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_________(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是_________。
A.加入催化剂 B.缩小容器体积
C.升高温度D.加入一定量的N2O4
近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K=。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向容积为2 L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则T℃时该反应的平衡常数K=。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如图所示。(已知: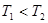 )
)
①反应2NO(g) N2(g)+O2(g)为(填“吸热”或“放热)反应。
N2(g)+O2(g)为(填“吸热”或“放热)反应。
②一定温度下,能够说明反应 2NO(g) N2(g)+O2(g)已达到平衡的是(填序号)。
N2(g)+O2(g)已达到平衡的是(填序号)。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用 CxHy(烃)催化还原NO2消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)=CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H3=-867kJ·mol-1,
△H2=.
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为。
合成氨工业的核心反应是:N2(g)+3H2(g) 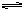 2NH3(g) ΔH="Q" kJ·mol-1,能量变化如图所示,回答下列问题:
2NH3(g) ΔH="Q" kJ·mol-1,能量变化如图所示,回答下列问题: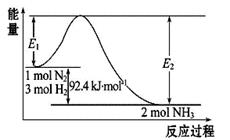
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________(填“增大”、“减小”、“不变”)
(2)在500 ℃、2×107 Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_________ 46.2 kJ(填“<”、“>”或“=”)
(3)关于该反应的下列说法中,正确的是_________。
A.ΔH>0,气体分子数目增多 B.ΔH>0,气体分子数目减少
C.ΔH<0,气体分子数目增多 D.ΔH<0,气体分子数目减少
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率_________。若升高温度,K值变化_______(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中欲提高合成氨中H2的转化率,下列措施可行的__(填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨气
过渡元素具有较多的空轨道,所以第四周期的Cr、Fe、Co、Ni、Cu、Zn等多种金属能形成配合物。
(1)铬元素的基态原子的外围电子排布式是。
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:
图中虚线表示的作用力为______________________;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是__,其中心原子的杂化轨道类型是___;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是___,Ni(CO)4易溶于下列 __(用序号作答)。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
(5)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子最外层电子数是其内层的3倍。X与Y所形成化合物晶体的晶胞如图所示,该化合物的化学式为____。