甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。①CH4(g)+H2O (g) CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)
CO(g)+3H2(g) △H1 ②CO(g)+2H2(g) CH3OH(g)△H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
CH3OH(g)△H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示: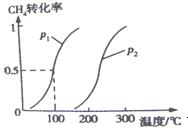
(1)温度不变,缩小体积,增大压强,①的反应速率 (填“增大”.“减小”.“不变”),平衡向 方向移动。
(2)反应①的△H1 0,(填“﹤”“﹦”“﹥”),其平衡常数表达 式为K= ,100℃,压强为p1时平衡常数的值是 。
式为K= ,100℃,压强为p1时平衡常数的值是 。
(3)在压强为0.1Mpa条件下,将a mol CO与3a molH2的混合气体在催化剂作用下进行反应②。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下空格中填入剩余的实验条件数据。
| 实验编号 |
T℃ |
n(CO)/n(H2) |
p (Mpa) |
| I |
150 |
1/3 |
0.1 |
| Ⅱ |
|
|
5 |
| Ⅲ |
350 |
|
5 |
(4)近几年开发的甲醇燃料电池是采用铂电极,电池中的质子交换膜只允许质子和水分子通过,其工作原理示意图如下: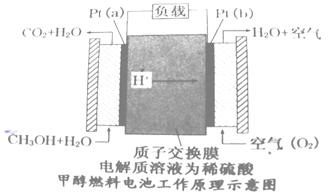
请回答
①Pt(a)电极的电极反应式为
②如果该电池工作时电路中通过2mol电子则消耗的CH3OH有 mol。
燃料电池是目前正在探索的一种新型电池。它主要是利用燃料在燃烧过程中把化学能直接转化为电能,目前已经使用的氢氧燃料电池的基本反应是
x极:O2(气)+2H2O(液)+4e-=4OH-
y极:H2(气)+2OH--2e-=2H2O(液)
回答下列问题:
(1)x是________极,发生________反应。(填“氧化”或“还原”,下同)
(2)y是________极,发生________反应。
总反应方程式为______________________。
(3)若反应后得到5.4 g液态水,此时氢氧燃料电池转移的电子数为________。
ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是______________________________________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应______________________________________
银片上发生的电极反应______________________________________
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);②通过导线的电量。(已知NA=6.02×1023 mol-1,电子电荷为1.60×10-19 C)
某研究性学习小组探究如下实验:在常温下,取两片质量相等、外形和组成相同且表面经过砂纸打磨完全去掉氧化膜的铝片,分别加入盛有相同体积、H+浓度相同的稀硫酸和稀盐酸的两支大小相同的试管中,发现铝片在稀盐酸中产生氢气的反应速率比在稀硫酸中的快。查阅相关资料后得知:化学反应速率主要由参加反应的物质的性质决定,其次是外界因素的影响。
(1)写出以上反应的离子方程式_______________________________。
(2)出现上述现象的原因可能:假设①SO42—对铝与H+的反应有抑制作用;假设②______________________________________。
(3)请设计实验对上述假设进行验证:
①____________________________________________;
②____________________________________________。
(4)如果上述假设都成立,要使上述稀硫酸与铝反应产生氢气的速率加快,可以采取的措施有:
①__________________________________________________;
②__________________________________________________;
③__________________________________________________;
④__________________________________________________。
氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O 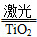 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,________能转变为________能,二氧化钛作________。生成的氢气用于燃料电池时,________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应如下:
A极:2H2+2O2--4e-=2H2O
B极:O2+4e-=2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。