随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。 Ⅰ.MnFe2O4的制备:
Ⅰ.MnFe2O4的制备:


 已知Fe3+、Mn2+沉淀的pH为下表所示。
已知Fe3+、Mn2+沉淀的pH为下表所示。
 (1)此工艺中理论
(1)此工艺中理论 上投入原料Fe(NO3)3和Mn(NO3)2
上投入原料Fe(NO3)3和Mn(NO3)2 的物质的量之比应为 。
的物质的量之比应为 。 (2)步骤二中b的值为 。
(2)步骤二中b的值为 。 (3)步骤三中洗涤干净的标准是 。
(3)步骤三中洗涤干净的标准是 。 Ⅱ.用MnFe2O4热化学循环制氢:
Ⅱ.用MnFe2O4热化学循环制氢: MnFe2O4(s)→MnFe2O(
MnFe2O4(s)→MnFe2O( 4-x)(s) +
4-x)(s) +  O2(g);△H1
O2(g);△H1  MnFe2O(4-x)(s)+ xH2O →MnFe2O4(s) + xH2(g);△H2
MnFe2O(4-x)(s)+ xH2O →MnFe2O4(s) + xH2(g);△H2 请回答下列问题:
请回答下列问题: (4)若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+在全部铁元素中的质量分数为
(4)若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+在全部铁元素中的质量分数为  。
。 (5)该热化学循环制氢的优点有 (填序号)。
(5)该热化学循环制氢的优点有 (填序号)。 A.过程简单、无污染 B.物料可循环使用
A.过程简单、无污染 B.物料可循环使用  C.氧气和氢气在不同步骤生成,安全且易分离
C.氧气和氢气在不同步骤生成,安全且易分离 (6)已知 2H2(g)+O2(g)= 2H2O(g);△H3
(6)已知 2H2(g)+O2(g)= 2H2O(g);△H3 则:△H3与△H1、△H2的关系为△H3= 。
则:△H3与△H1、△H2的关系为△H3= 。
有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种。现做如下实验:
一、取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成。
二、另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用下图表示。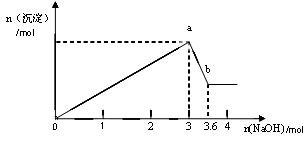
试推断:
(1)该溶液中一定存在______________,一定不存在________________。
(2)由图可知白色沉淀共有__________种,分别是__________________(填化学式),其物质的量比为。
(3) 写出图中a b变化过程的离子方程式。
b变化过程的离子方程式。
苯甲酸甲酯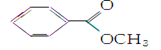 是一种重要的工业用有机溶剂。请分析下列有机物的结构简式或性质特点,然后回答问题。
是一种重要的工业用有机溶剂。请分析下列有机物的结构简式或性质特点,然后回答问题。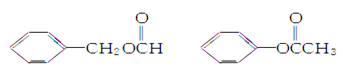
甲 乙
| 丙的分子式 |
C7H8O |
| 丙的部分性质 |
熔融状态下能与钠反应放出氢气 |
| 与乙酸能发生酯化反应 |
(1)乙中含氧官能团的名称是________。
(2)甲、乙、丙三种有机物中与苯甲酸甲酯是同分异构体的是________,在加热条件下能够与新制氢氧化铜悬浊液反应生成红色沉淀的是________,与NaOH溶液在加热条件下反应消耗NaOH最多的是________。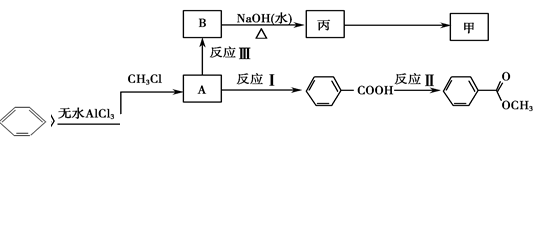
(3)已知:苯在无水AlCl3的作用下与卤代烃发生反应,可以在苯环上增加烷基。
①一定条件下,下列物质不能与A反应的是________(填字母序号)
a.酸性KMnO4溶液b.溴的CCl4溶液 c.氢气d.氯气
②丙生成甲的反应类型与________(选填序号)的反应类型相同。
a.反应Ⅰ b.反应Ⅱ c.反应Ⅲ
③写出B生成丙的化学方程式:_________________________________。
(1)下列曲线表示卤素元素某种性质随核电荷数的变化趋势,正确的是____________。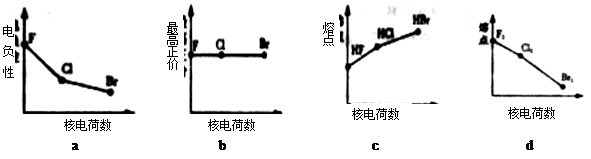
(2)利用“卤化硼法”合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为________,该功能陶瓷的化学式为___________。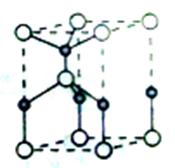
(3)BCl3和NCl3中心原子的杂化方式分别为________和_________。第一电离能介于B、N之间的第二周期元素有________种。
(4)若BCl3与XYm通过B原子与X原子间的配位健结合形成配合物,则该配合物中提供孤对电子的原子是________。
(5)SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。
长石是金属铝硅盐。由钠长石化学式NaAlSi3O8可推知钙长石改写成氧化物的形式可表示为
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+ 2H2O,该反应的还原剂是,当1mol O2发生反应时,还原剂所失电子的物质的量为mol。向CuSO4溶液中加入镁条时有气体生成,该气体是
(3)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为
(4)某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下: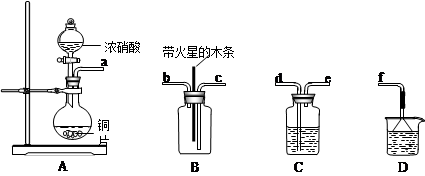
①按气流方向连接各仪器接口,顺序为a→______→______→______→______→f。
②已知二氧化氮和碳反应生成两种物质的量比为1:1的有毒气体,则该反应的化学方程式为:___________________________。
下面是提纯大理石(主要杂质是氧化铁)的流程图:
按要求回答下列问题:
(1)在工业生产中,将块状大理石磨成粉末,并在反应池中安装搅拌机。目的是________。由滤液B得到晶体B,操作过程包括___________(填操作名称)、冷却结晶。
(2)操作Ⅱ中A物质最好应选择___________(填化学式),在该过程中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是______________________________。
(3)检验Fe3+已完全生成Fe(OH)3沉淀的方法是________________________________。
(4)写出大理石溶解时,发生反应的离子方程式_______________;_________________.