有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱。请回答:
(1)某同学胃酸过多,应选用的药物是 (填序号,下同)
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是
(4)滥用药物会导致不良后果,如过量服用 会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3溶液。
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的第一电离能由大到小的顺序为 。
(3)与OCN-互为等电子体的一种分子为 (填化学式)
(4)铁元素还能与一些氨基酸形成配合物,羧基中碳原子的杂化类型是 ;1mol乙酸中含有σ键的数目为 。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为 。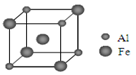
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g) △H=+116.0kJ·mol-1
热化学方程式:Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H= kJ·mol-1。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 mol。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。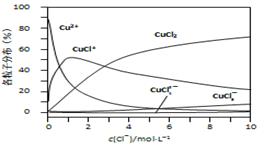
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
从环境保护的角度看,催化脱硫的意义为 。
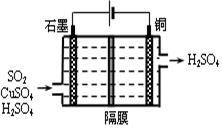
②利用上图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
铝铁合金在微电机中有广泛应用,某兴趣小组为利用废弃的铝铁合金设计了如下实验流程制备聚合硫酸铁和明矾: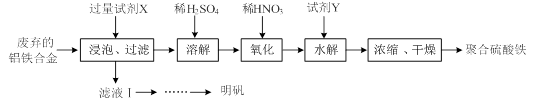
(1)聚合硫酸铁是一种无毒无害、化学性质稳定、能与水混溶的新型絮凝剂,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
①聚合硫酸铁可用于净水的原理是 。
②有人认为上述流程中的“氧化”设计存在缺陷,请提出改进意见: ;浓缩时向其中加入一定量的乙醇,加入乙醇的目的是 。
③加入试剂Y的目的是调节pH,所加试剂Y为 ;溶液的pH对[Fe2(OH) x(SO4)y]n中x的值有较大影响(如图1所示),试分析pH过小(pH<3)导致聚合硫酸铁中x的值减小的原因: 。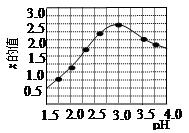
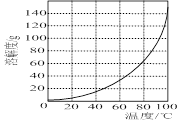
图1图2
(2)明矾是一种常见铝钾硫酸盐。
①为充分利用原料, 试剂X应为 。
②请结合图2所示的明矾溶解度曲线,补充完整由滤液Ⅰ制备明矾晶体的实验步骤(可选用的试剂:废弃的铝铁合金、稀硫酸、NaOH溶液和酒精):向滤液Ⅰ中加入足量的含铝废铁屑至不再有气泡产生, ,得到明矾晶体。
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 ;
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 ;
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
(1)“酸浸”时保持H2SO4过量的目的是 ;
(2)写出氧化时的离子方程式: ;
(3)流程中调节pH=5.4所加试剂X为 (填序号);
A.NaOH B.ZnO C.ZnCO3
滤渣1的成分为 (写化学式);
(4)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为 (填化学式);
(5)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为 。