依据事实,写出下列反应的热化学方程式。
(1)在250C、101KPa时,1克甲醇(CH30H)完全燃烧生成CO2和液态水时放热22.68KJ,则能表示甲醇燃烧热的热化学方程式为 。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示该反应中和热的热化学方程式为: 。
如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。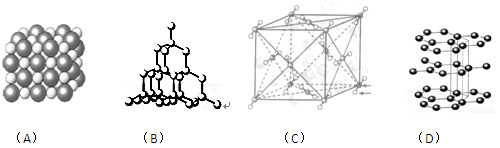
(1)其中代表金刚石的是(填编号字母,下同),金刚石属于晶体。
(2)其中代表石墨的是,其晶体中碳原子呈平面结构排列。
(3)其中代表NaCl的是,晶体中Na+与Cl-之间通过键结合起来。
(4)代表干冰的是,它属于晶体,CO2分子间通过结合起来。
(5)上述物质中前三种熔点由高到低的排列顺序为。
下列反应在210℃时达到平衡:
①PCl5(g) PCl3(g)+Cl2(g);△H1>0K1=1mol·L—1
PCl3(g)+Cl2(g);△H1>0K1=1mol·L—1
②CO(g)+Cl2(g) COCl2(g);△H2<0K2=5×104L·mol—1
COCl2(g);△H2<0K2=5×104L·mol—1
③COCl2(g) CO(g)+Cl2(g)△H3K3
CO(g)+Cl2(g)△H3K3
④2SO2(g)+O2(g) 2SO3(g);△H4<0
2SO3(g);△H4<0
(1)反应③的平衡常数K3为。
(2)要使反应①和反应②的K数值相等,可采取的措施是(填序号)。
A.降低反应①、②体系中Cl2浓度 B.反应①、②选择不同的催化剂
C.反应①、反应②同时升高温度 D.反应①、反应②同时降低温度
E.反应①降低温度,反应②维持210℃
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定。起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡。下列有关它们达到平衡状态后的叙述正确的是(填序号)。
A.体积:甲可能小于乙 B.SO3的物质的量:甲一定小于乙
C.压强:甲可能大于乙 D.浓度比c(SO2)/c(SO3):甲一定小于乙
(4)丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为15mol。现向容器中加入xmolSO2,6.5mol O2,2.0molSO3。
①若x=5.5,需要(填“降低”“升高”或“保持”)体系温度,使反应在平衡时达到题设要求;
②欲使起始反应维持向逆反应方向移动,则x的取值范围为。
(1)反应Fe(s)+CO2(g) FeO(s)+CO(g)△H1,平衡常数为K1
FeO(s)+CO(g)△H1,平衡常数为K1
反应Fe(s)+H2O(g) FeO(s)+H2(g)△H2,平衡常数为K2
FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如下表:
| 700℃ |
900℃ |
|
| K1 |
1.47 |
2.15 |
| K2 |
2.38 |
1.67 |
①反应 CO2(g) + H2(g) CO(g) + H2O(g) △H,平衡常数K,则△H=(用△H1和△H2表示),K=(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数K,则△H=(用△H1和△H2表示),K=(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) CO(g) + H2O(g)是反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是反应(填“吸热”或“放热”)。
②能判断CO2(g) + H2(g) CO(g) + H2O(g)达到化学平衡状态的依据是(填序号)。
CO(g) + H2O(g)达到化学平衡状态的依据是(填序号)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) △H > 0,CO2的浓度与时间的关系如图所示: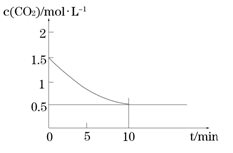
①该条件下反应的平衡常数为;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度mol·L-1。
②下列措施中能使平衡时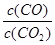 增大的是(填序号)
增大的是(填序号)
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
材料1:铁及其化合物在工农业、生活中有广泛的应用。高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是;发生反应的△H0(填“>”、“<”或“=”)。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O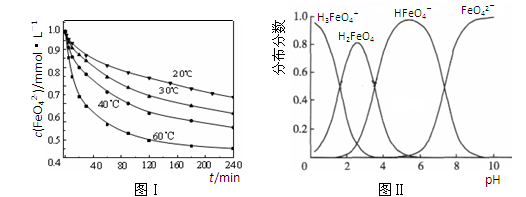
材料2:化合物KxFe(C2O4) y·zH2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:
(4)结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是。
(5)操作Ⅲ的名称是。
Ⅱ.组成测定:
称取0.491g实验所得晶体(假设是纯净物)置于锥形瓶中,加足量蒸馏水和稀H2SO4。将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液12.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液2.00mL。相关反应如下:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(6)配制250mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有和。两个滴定中到达终点时溶液颜色为色,且30秒内不变色。
(7)通过计算,求此光敏材料的化学式。
一定条件下,在一容积可变的密闭容器中,反应: 过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表:
过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表: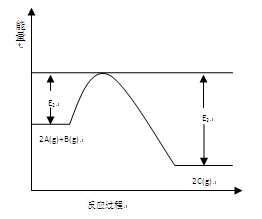
| 时间(min) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| n(A) |
2.00 |
1.90 |
1.82 |
1.76 |
1.64 |
1.54 |
1.50 |
1.50 |
1.50 |
| n(B) |
1.00 |
0.95 |
0.91 |
0.88 |
0.82 |
0.77 |
0.75 |
0.75 |
0.75 |
| n(C) |
0 |
0.10 |
0.18 |
0.24 |
0.36 |
0.46 |
0.50 |
0.50 |
0.50 |
回答下列问题:
(1)反应 的正反应△H(填“大于”或“小于”)0。
的正反应△H(填“大于”或“小于”)0。
(2)该反应平衡时,下列说法不正确的是
(A)气体的密度不再改变(B)A的物质的量浓度不变
(C)放出或吸收的热量不再变化(D)v正(A)=v逆(A)=0
(3)toC时,在一容积为2L的恒容密闭容器内加入0.4molA和0.6molB,在一定条件下发生反应,反应中C的物质的量浓度变化情况如下图: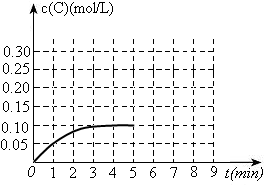
①该温度下,反应: 的平衡常数K=。
的平衡常数K=。
②反应进行到1分钟时B物质的量为。
③在第5min时,将容器的体积缩小一半后,若在第8min达到新的平衡时A的总转化率为75%,请在上图中画出第5min到新平衡时C的物质的量浓度的变化曲线。