盛极一时一种实验室常用的化学试剂,请按要求填空: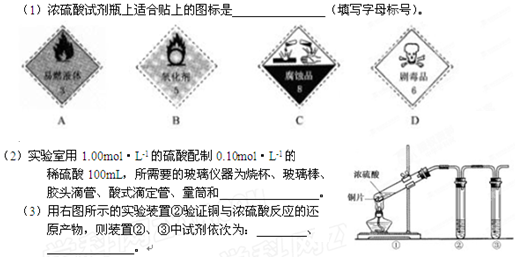
(4)装置①的反应方程式
若装置①中加入铜6.4克和含有0.2摩尔硫酸的浓硫酸产生二氧化硫
A 等于6.4克 B 大于6.4克 C 小于6.4克 D不能确定
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组测定某葡萄酒中SO2含量。步骤如下:
(1)取300.00 mL葡萄酒,加入适量盐酸,加热使SO2全部逸出
(2)逸出的SO2被稍过量的H2O2完全吸收氧化
(3)加热(2)中溶液,除尽过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,以酚酞为指示剂,滴定到终点,记录消耗NaOH溶液的体积
(4)重复上述操作2~3次
试回答:(1)步骤2中H2O2氧化SO2的化学方程式为__________________________。
(2)NaOH标准溶液用滴定管(填“碱式或酸式”)盛装。
(3)到达滴定终点时,溶液由色变为________色,且半分钟内不再变化;
(4)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10.00”处,则管内液体的体积(填序号)________(①=10.00 mL,②=40.00 mL,③<10.00 mL,④>40.00 mL)。
(5)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为______g·L-1
(6)以下操作使所测得的SO2含量偏高的是
A.滴定前,未用NaOH标准溶液润洗滴定管
B.滴定前滴定管内无气泡,终点读数时有气泡
C.滴定前仰视读数,滴定终点时读数正确
某化学兴趣小组,拟探究和比较SO2和C12的漂白性,设计如下图所示的实验装置二套。请你参与探究并回答下列问题。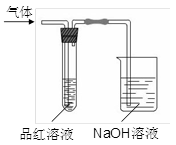
(1)向第一套装置中通入一段时间的SO2,观察到试管中的品红溶液褪色,然后再加热试管,溶液(填“恢复”或“不恢复”)红色;
(2)向第二套装置中通入一段时间的C12,观察到试管中的品红溶液也褪色,然后再加热试管,溶液(填“恢复”或“不恢复”)红色;
(3)由以上两个实验可以说明SO2和C12的漂白原理(填“相同”或“不相同”);
(4)C12通入品红溶液中,生成的具有漂白性的物质是(填“HC1”或“HClO”)。
(共16分)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图: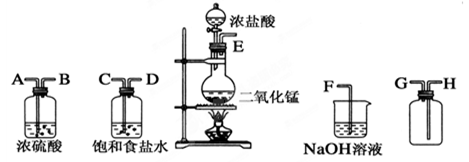
(1)连接上述仪器的正确顺序(填各接口处的字母):E接________;__________接__________;
________接________;__________接F。
(2)装置中,饱和食盐水的作用是______________;浓硫酸的作用是____________。
(3)化学实验中检验是否有Cl2产生的常用方法是________,反应的离子方程式_____________。
(4)写出下列反应的化学方程式:
①气体发生装置中进行的反应:____________________________________。
②NaOH溶液中发生的反应:______________________________________。
(5)如果将10 mL 12 mol·L-1的浓盐酸与足量MnO2充分反应,实际能收集到的氯气在标准状况下的体积将________。
| A.≥ 0.672L | B.> 0.672 L | C.≤ 0.672 L | D.< 0.672 L |
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(I)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mL O2所需的时间(秒)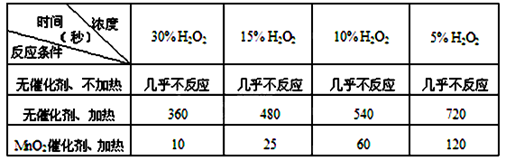
①研究小组在设计方案时。考虑了浓度和因素对过氧化氢分解速率的影响。
②上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响。
(Ⅱ)将质量相同但聚集状态不同的MNO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
| 催化剂(MNO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合 不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
| 块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2发生的化学反应方程式。
②实验结果说明催化剂作用的大小与有关。
溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/°C |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
(1)仪器乙的名称为:;
(2)用上图的装置制备溴苯时的操作为:向甲中预先加入少量铁屑,再加入适量苯,丙中预先装好适量液溴,将丙中所装的液溴缓慢滴入甲中,充分反应。反应中铁屑的作用是:;写出制备溴苯的化学反应方程式是:;
(3)丁装置烧杯中倒置的漏斗的目的是:;写出丁中发生的主要化学反应的方程式为:;
(4)充分反应后,向甲中加入适量水,然后过滤除去未反应的铁屑;所得到滤液就是制得的粗溴苯,其中含有未反应完的液溴,最好应选择试剂除去,
A.氢氧化钠溶液 B.稀盐酸溶液C.氯化钠溶液D.水
经过上述操作所得的粗溴苯中还含有杂质苯,要进一步提纯,应选下列哪种操作除去。
E.重结晶 F.过滤G.蒸馏 H.萃取