(本题共10分) A、B、C、D 四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和。则元素:A为 B为 C为 ,D的质子数和中子数相等,D 的原子符号为: ,它的最高价氧化物对应的水化物: 。
(共10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____________,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式______。
(4)用电子式表示元素④与⑥的化合物的形成过程:,该化合物属于(填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式,该化合物是由(填“极性”或“非极性”)键形成的。
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称________;B在周期表中的位置:第________周期,第________族;
(2)A、B形成的化合物的化学式________;
(3)C的元素符号________,C的最高价氧化物的化学式________;
(4)D的最高价氧化物对应的水化物的化学式________________。
(共4分)下列五种物质中 ①Ne ②H2O ③NH3 ④KOH ⑤Na2O(填写序号):只存在共价键的是,只存在离子键的是,既存在共价键又存在离子键的是,不存在化学键的是。
(共4分)(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上(填“有”或“没有”)气泡产生。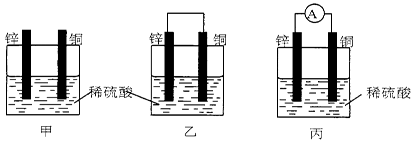
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。有关的电极反应式:
锌片________________;铜片________________
在容积为10 L的容器中,通入一定量的CO和H2O(g),在850℃时发生反应CO(g) + H2O CO2(g) + H2(g)ΔH < 0。CO和H2O浓度变化如图所示。
CO2(g) + H2(g)ΔH < 0。CO和H2O浓度变化如图所示。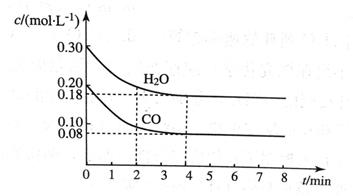
(1)则0~4 min内反应速率v(CO)为__________mol/(L·min);
(2)1000℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
1000℃时物质浓度的变化
| t/min |
c(CO)/(mol·L-1) |
c(H2O)/(mol·L-1) |
c(CO2)/(mol·L-1) |
c(H2)/(mol·L-1) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 1 |
0.138 |
0.238 |
0.062 |
0.062 |
| 2 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
0.084 |
| 6 |
0.096 |
0.266 |
0.104 |
0.104 |
①c1数值_____0.08 mol/L(填“<” “>” 或“=”);
②表中5~6 min之间数值发生变化,可能的原因是_______(填字母)。
a.增加水蒸气b.降低温度
c.使用催化剂 d.增加氢气浓度