物质在水中可能存在电离平衡、盐的水解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)0.01mol/L的NH4Cl溶液中各种离子的浓度由大到小顺序为 ;电荷守恒关系: ;浓度为0.01mol/L的是 ; 和 两种粒子的浓度之和是0.01mol/L。
(2 )CH3COONa溶液中存在的2个平衡体系分别为(分别用离子方程式表示): 、 ;
(3) FeCl3溶液与Na2CO3溶液混合后,反应的离子方程式为 .
(2013)X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期 ,其相关信息如下表:
(1)W位于元素周期表第周期第族;W的原子半径比X的 (填“大”或“小”)。
(2)Z的第一电离能比W的(填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25℃、101kPa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
()用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g),∆H1=-47.3kJ∙mol-1
②CaSO4(s)+CO(g)⇋CaO(s)+CO2(g) +SO2(g),∆H2=+210.5kJ∙mol-1
③CO(g)⇋1/2C(s)+1/2CO2(g),∆H3=-86.2kJ∙mol-1
(1)反应2CaSO4(s)+7CO(g)⇋CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)的∆H=___________(用∆H1、∆H2和∆H3表示)
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图,
结合各反应的∆H,归纳lgK-T曲线变化规律:
a)____________________________;
b)____________________________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900℃达到平衡,c平衡(CO)=8.0X10-5 mol∙L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入_______。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为_______________;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为___________。
氧化铝(Al2O3)和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为 。
(2)下列实验能比较镁和铝的金属性强弱的是 (填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 =" -3352" kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 =" -521" kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为 。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g)Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是 mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp= 。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为 以上。
()石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下: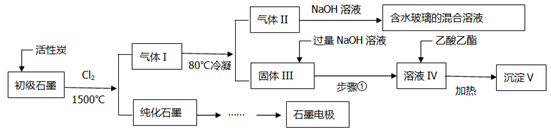
(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,气体I中的碳氧化物主要为________________________,由气体II中某物质得到水玻璃的化学反应方程式为_________________。
(3)步骤①为:搅拌、________、所得溶液IV中的阴离子有_______________。
(4)由溶液IV生成沉淀V的总反应的离子方程式为___________________,100kg初级石墨最多可获得V的质量为___________kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。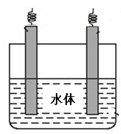
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00 %的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。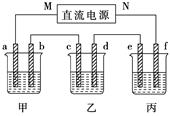
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为________极。
②电极b上发生的电极反应为 ___________________________________。
③列式计算电极b上生成的气体在标准状况下的体积: ___________________________________________________________。
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液______________________________________________;
乙溶液______________________________________________;
丙溶液______________________________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
_____________________________________________________________。