(6分) 氯气是一种重要的化工原料,在生产和生活中应用十分广泛。在实验室可用二氧化锰固体和浓盐酸制氯气。
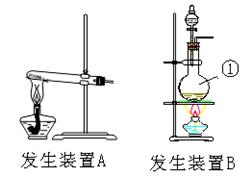
(1)请为该实验选择合适的发生装置 (填A或B),写出仪器①的名称
(2)当集气瓶中收集满氯气时,可以观察到气体呈 色。尾气通常用 吸收。
(3)工业上常用电解饱和食盐水制取氯气,试写出该反应的化学方程式:
。
氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。当悬浮物较多时,停止制备。
注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是 ,液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是 (填写选项序号)。
a.常压加热烘干
b.高压加热烘干
c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 |
得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 |
若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 |
,证明固体中含有碳酸氢铵。 |
②根据①的结论:取氨基甲酸铵样品3.95 g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97 g。则样品中氨基甲酸铵的物质的量分数为 。[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197]
硫代硫酸钠(Na2S2O3)商品名“海波”,俗名“大苏打”,分析化学上常用于滴定实验。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。
已知:Na2SO3 + S = Na2S2O3
I.制备Na2S2O3
(1)如图,组装好仪器,检验完气密性(气密性良好),各装置试剂均装入后的下一步操作是______________________________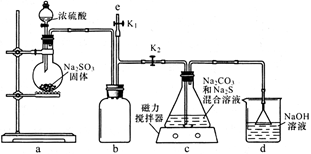
(2)反应开始后,C中发生了多个化学反应。写出其中任意一个非氧化还原反应的方程式___________________________________。
(3)装置c中反应结束后, 先关闭分液漏斗旋塞,在e处连接盛NaOH溶液的注射器,再关闭K2打开K1,其目的是______________________________。待c中溶液冷却后,倒入蒸发皿,通过加热蒸发、冷却结晶和干燥等操作获得Na2S2O3·5H2O晶体。
Ⅱ.探究Na2S2O3的部分化学性质
【提出假设】
假设一:Na2S2O3与Na2SO4结构相似,化学性质也应该相似,因此室温时Na2S2O3 溶液pH=7。
假设二:从S元素的化合价推测Na2S2O3具有较强的还原性。
【验证假设】配制适量Na2S2O3溶液,进行如下实验(请填空)
| 实验操作 |
实验现象 |
现象解释(用离子方程式表示) |
|
| 假设一 |
___________________ |
溶液pH=8 |
________________________ |
| 假设二 |
向溴水中滴入适量Na2S2O3溶液 |
溴水褪色 |
___________________________ |
【实验结论】______________________。
Ⅲ:用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
根据上述步骤计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)
化学实验离不开水。请根据水的不同作用和功能,分析以下四个装置图,回答问题:
实验一:制取氢气
(1)图甲所示装置可用于实验室制取氢气,这种制气装置在加入反应物前,如何检查气密性 。
(2)用锌与稀硫酸制取氢气时,加入少量硫酸铜溶液会加快产生氢气的速率,请解释加快反应速率的原因: 。
实验二:喷泉实验
(3)图乙所示装置中烧瓶已装满干燥氨气, 进行喷泉实验时应该先___________(填“挤捏胶头滴管”或“打开止水夹”)。
(4)如果只提供如图丙所示装置,若想迅速引发喷泉,下列方法可行的是 。
a.用热毛巾捂住烧瓶
b.用冰块捂住烧瓶
c.将烧杯中的水换成饱和食盐水
d.向烧杯中加入少量硫酸
实验三:探究一定温度下能使铁钝化的硝酸的最低浓度,实验装置如图丁所示。
①开始实验时,观察到灵敏电流计指针指向铜丝,但又迅速反转指向铁丝;
②再用盛蒸馏水的注射器缓慢向具支试管内加水并振荡,在指针恰好开始反转指向铜丝时停止实验;
③重复三次实验得平均加水量为2.5 mL(水的密度按1.0g/mL计算)。
(5)该实验装置的不足之处是__________________________。
(6)当指针第一次指向铜丝时,正极的电极反应式为 。
(7)根据此实验计算,使铁钝化的硝酸最低质量分数为 。
研究物质的合成或制备是有机化学、无机化学的重要任务之一。
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了以下装置: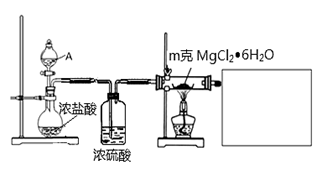
①分液漏斗中的A物质是________________(填试剂名称)。
②利用中学常见的仪器,在答题卡中补充完整实验装置(不必画出夹持装置)。可选择的试剂有:稀NaOH溶液、无水氯化钙、稀硫酸、浓硫酸。
③假设实验过程中MgCl2▪6H2O未水解,不用任何试剂用最简单的方法检验MgCl2▪6H2O是否完全转化为MgCl2。写出实验方法________________。
④工业生产中得到无水氯化镁可用于电解制备镁单质,电解装置中,镁在____极析出。
(2)实验室制备并收集纯净乙烯
①有的同学通过乙醇发生消去反应进行实验。除乙醇外,所需的试剂或用品(不包括仪器)有_________________。
②有的同学探究其它制备乙烯的方法,他设计了以下装置制备乙烯。实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,请分析气体产率很低的原因主要是______________________。为增大气体产率,在下图装置的基础上,提出一点改进措施__________________。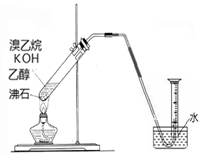
从实验安全角度考虑,该实验很可能发生的问题是________________。
三个化学小组的同学测定某Na2CO3固体样品(仅含NaOH杂质)的纯度,他们提出了各自的气体分析法。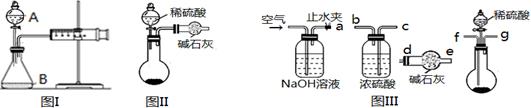
(1)第一小组用图I所示装置,仪器A的名称 。把m1 g的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时需检查该装置气密性,具体的操作方法是 。
(2)第二小组用图II装置测定CO2的质量。该装置存在明显缺陷是 。
(3)第三小组在第二小组装置的基础上,解决了第二小组装置的问题。所用到的仪器如图III,装置的连接顺序是a— (填写接口字母,图中仪器可重复使用)。实验中取了样品m1 g,称量干燥管质量为m2 g,与足量稀硫酸反应后称量干燥管质量为m3 g,则Na2CO3的纯度表达式为 。