某同学在用托盘天平称量氯化钠时,物质和砝码放颠倒了,他要称量10.3克氯化钠,实际称量的氯化钠的质量为 g
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。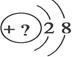
(1)该微粒是中性微粒,这种微粒的元素符号是____________;
(2)该微粒的符号为X3-,则这种微粒的单质的电子式为___________;
(3)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式___________________________________;
(4)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与水反应的离子方程式:________________________________;
(5)该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式:__________;
(6)该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式:______________________.
N是重要的非金属元素,尿素、羟胺、硝酸、亚硝酸钠均为重要的含氮化合物。
(1)尿素[CO(NH2)2]是人类利用无机物合成的第一种有机物。
①尿素中元素原子半径最大的原子结构示意图为;
②尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因 ;
③已知:20oC时,H2CO3:Ka1=4.2×10ˉ7、Ka2=5.6×10ˉ11;NH3·H2O:Kb=1.7×10ˉ5,碳酸氢铵溶液中HCO3ˉ、NH4+、OHˉ、H+四种离子浓度由大到小的顺序为
(2)羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂。
①利用羟胺的还原性,可以除去含Fe2+中的Fe3+,氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式;
②制备NH2OH·HCl(盐酸羟胺)的一种工艺流程如下图所示: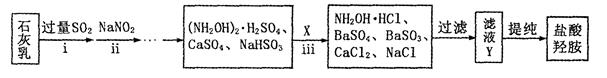
ⅰ步骤中,发生反应的化学方程式为;
ⅱ步骤中使用的NaNO2外观酷似食盐,误食会中毒。可用电解法将工业废水中少量的NO2ˉ转化为N2以降低其危害。写出NO2ˉ在酸性条件下转化为氮气的电极反应式为 ________ 。
ⅲ步骤中,X为(填化学式);若要使滤液Y中SO42ˉ、SO32ˉ浓度均小于1×10ˉ5mol/L,溶液中Ba2+浓度应不小于[已知KSP(BaSO3)= 5.0×10ˉ10;KSP(BaSO4)= 1.1×10ˉ10]
③用惰性电极电解硝酸溶液可制备NH2OH。写出其阳极反应式;
(本题15分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为(填化学式)。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为__________。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为___________;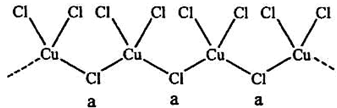
(4)Cu2O的熔点比Cu2S的(填“高”或“低”),请解释原因_________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(6)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
(7)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu===2Fe2++Cu2+,请写出其第l步反应的离子方程式__________________________________。
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为,请预测B的核磁共振氢谱上有 个峰(信号)。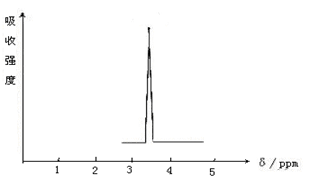
(2)用系统命名法命名下列物质
①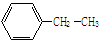
②CH3CH2CH=CHCH3
(3)写出结构简式或名称:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃结构简式________
②戊烷(C5H12)的某种同分异构体只有一种一氯代物,写出该戊烷的名称_____
(1)某温度下,2 L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
①反应的化学方程式为___________________________________________________;
②0~10 s内,用Z表示的化学反应速率____________________________________;
③X的转化率为__________________;(转化率是指平衡时某物质反应的物质的量与起始物质的量的百分比)
(2)在一定温度下,可逆反应A(g)+3B(g)  2C(g)达到平衡的标志是()
2C(g)达到平衡的标志是()
A.A的生成速率与C分解的速率相等
B.单位时间内生成nmolA,同时生3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1:3:2