㈠已知涤纶树脂的结构简式为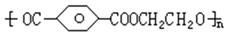 ,写出合成涤纶树脂所需的单体的结构简式;
,写出合成涤纶树脂所需的单体的结构简式;
㈡A、B两种有机化合物,分子式都是C9H11O2N;
⑴化合物A是天然蛋白质的水解产物,光谱测定显示,分子结构中不存在甲基(-CH3),化合物A的结构简式是________________________;
⑵化合物B是某种分子式为C9H12的芳香烃一硝化后的唯一产物(硝基连在苯环上),化合物B的结构简式是________________________。
迷迭香酸(F)的结构简式为: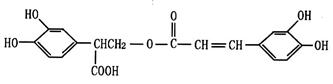
它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下(已知苯环上的羟基很难直接与羧酸发生酯化反应):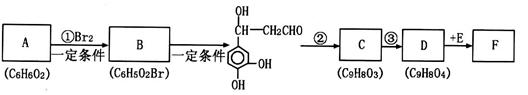
根据题意回答下列问题:
(1)A的结构简式为;反应②的反应类型是。
(2)反应③的试剂为。
(3)1molF分别与足量的溴水和NaOH溶液反应,最多可消耗Br2mol, NaOHmol。
(4)E在一定条件下发生缩聚反应的化学方程式是。
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
回答下列问题:
(1)Mn元素价电子的电子排布式为,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fen再失去一个电子难。其原因是。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是。
②络离子[Fe(CN)6]4-的配体CN-中C原子的杂化轨道类型是,写出一种与 CN-互为等电子体的单质分子的电子式。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为。
(4)金属铁晶体在不同的温度下有两种堆积方式,如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为。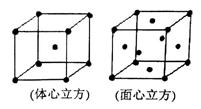
海洋是一个巨大的化学资源宝库,下图是海水加工的示意图: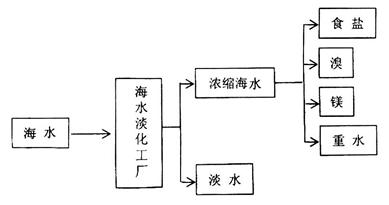
(1)海水淡化工厂通常采用的制备淡水的方法有(写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中试剂A的化学式,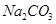 溶液中发生反应的化学方程式为。
溶液中发生反应的化学方程式为。
(3)制备金属镁是通过电解熔融的 ,而不用MgO,其原因是
,而不用MgO,其原因是
。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2。海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是。电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是。
已知HA是一种弱酸。请回答下列问题:
(1)现有一种含有HA和其钠盐NaA的溶液。
①组成该溶液的微观粒子有;
②若向该溶液中加入少量盐酸时,发生反应的离子方程式是;
③若向该溶液中逐滴加入NaOH溶液时,下列图像能表示 离子数目变化趋势的是(填字母)。
离子数目变化趋势的是(填字母)。
(2)现将1体积0.04mol 溶液和1体积0.02mol
溶液和1体积0.02mol NaOH溶液混合,得到2体积混合溶液。
NaOH溶液混合,得到2体积混合溶液。
①若该混合液显碱性,则其 0.01 mol
0.01 mol (填“<”、“=”或“>”);
(填“<”、“=”或“>”);
②若该混合液显酸性,则溶液中所有离子的浓度由大到小的顺序是。
氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:① =
= mol
mol
② =
= mol
mol
③ =
= mol
mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式。
(2)生产甲醇的原料CO和H2来源于下列反应:
①一定条件下 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则
 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数( )的大小关系为;
)的大小关系为;
②100℃时,将1 mol  和2 mol
和2 mol  通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是(填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是(填序号)。
a.容器的压强恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
c.容器内气体密度恒定
d.
如果达到平衡时 的转化率为0.5,则100℃时该反应的平衡常数K=。
的转化率为0.5,则100℃时该反应的平衡常数K=。
(3)某实验小组利用CO(g)、 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为。