能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,基态镍原子M层上的未成对电子数为 。
(2)大阪大学近日宣布,有机太阳能固体电池效率突破5.3%,而高纯度C60是其“秘密武器”。C60的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中π键的数目为 。
(3)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图2。该结构中,碳氮之间的共价键类型有 (按原子轨道重叠方式填写共价键的类型),请在下图2中用箭头表示出配位键。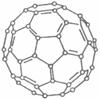
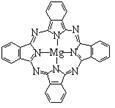
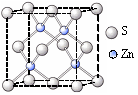
图1 图2 图3
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As Se(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如图所示),硫离子的配位数是 。
③二氧化硒分子的空间构型为 。
④砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为 。
一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂。制备一溴乙烷的反应原理为:NaBr+H2SO4=HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O。实验室可用如下装置制备一溴乙烷:
某学生的实验过程和具体操作可简述如下:
查阅资料可知:
①可能产生的副产物有: CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2,其中1,2-二溴乙烷为无色液体,熔点9.3℃,沸点131.4℃。
②油层a用浓硫酸处理可以除掉乙醚、乙醇和水等杂质。
请结合以上信息回答下列问题:
(1)实验过程中锥形瓶置于冰水混合物中的目的是。
(2)水层a中的离子除Na+、H+、OH-和Br-外,还一定含有,检验该离子的方法是。
(3)油层a、b均呈微黄色。该学生猜测油层b除一溴乙烷外还可能含有其它一种或多种副产物,为验证其成分设计了如下的实验操作。
| 实验步骤 |
预期现象和结论 |
| 步骤1:将油层b转移至中,再加入足量稀 Na2SO3溶液充分振荡,静置。 |
|
| 步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置。 |
溶液分层,下层呈橙红色,证明。 |
| 步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中,至温度计升高至450C左右。 |
馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷。 |
(4)该同学在实验过程中加入了10mL乙醇(0.17mol),足量浓硫酸,适量水,以及0.15mol溴化钠,最后蒸馏获得了10.9g一溴乙烷产品。请计算产率(用小数表示,保留二位小数)。
(1)钠镁铝三种元素中第一电离能最大的是。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3•10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
(4)部分共价键键能数据如下表:
| 键 |
H-H |
N-H |
N-N |
N=N |
N≡N |
| 键能/kJ•mol-1 |
436 |
391 |
159 |
418 |
945 |
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式:。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 |
结构简式 |
熔点 |
沸点 |
水溶性 |
|
| 乙醇 |
C2H6O |
C2H5OH |
-114.3℃ |
78.4 °C |
互溶 |
| 二甲醚 |
C2H6O |
CH3OCH3 |
-138.5℃ |
-24.9℃ |
微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式。
(15分)含铬污水处理是污染治理的重要课题。污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是:
(1)加酸可以使CrO42-转化为Cr2O72-:2CrO42- + 2H+ Cr2O72- + H2O
Cr2O72- + H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1 mol•L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K=。
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为。而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3] =10-32,要使c(Cr3+)降低到10-5mol•L-1,溶液的pH应升高到。
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的极。
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液。Cr(OH)3溶于稀硫酸的化学方程式为。往100.00mL 0.1000 mol•L-1CrCl3溶液滴加1.000mol•L-1NaOH溶液, 请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图:
四种主族元素的性质或结构信息如下:
| 元素编号 |
相关信息 |
| X |
地壳中含量最大的金属元素;元素最高价为+3价。 |
| Y |
原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍。 |
| Z |
同周期主族元素中原子半径最小,常温下单质呈液态。 |
| M |
能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧。 |
(1)M的原子结构示意图是;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)(元素用元素符号表示,下同!)。
(2)Y单质溶于热浓的硫酸产生的气体的化学式为。
(3)能体现Z单质比Y单质活泼性强的一个化学方程式:。
(4)常温下,不能与X的单质持续发生反应的是(填选项序号) 。
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH溶液E.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按下图所示进行试验。装置通电后,连接电源(填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是。
(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.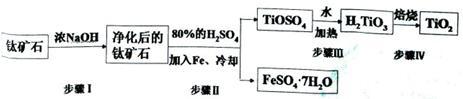
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。