Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a 。
(2)将装置C中两种液体分离开的操作名称是_________。装置D的作用是 。
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
已知CaO2·8H2O呈白色,微溶于水。I2+2S2O32-= 2I-+S4O62-
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
①判断此滴定实验达到终点的方法是: 。
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
(填“不受影响”、“偏低”或“偏高”),原因是 。
某化学小组在实验室模拟高炉炼铁,其部分装置如下: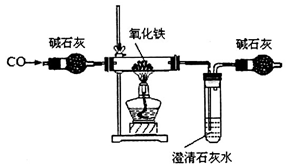
请完成下列填空:
(1)利用甲酸与浓硫酸反应HCOOH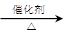 CO↑+H2O,制取CO,反应中浓硫酸的作用是___。
CO↑+H2O,制取CO,反应中浓硫酸的作用是___。
(2)判断上述装置中CO与氧化铁发生反应的现象为____________;该装置存在的缺陷是__________。
(3)已知受热不均时,可发生副反应CO+Fe2O3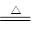 CO2+2FeO。为测定所得黑色产物中铁的含量,现有下列各有两根导管的甲、乙两试管,用橡皮管连接对应接口后,倒置盛稀硫酸的试管。
CO2+2FeO。为测定所得黑色产物中铁的含量,现有下列各有两根导管的甲、乙两试管,用橡皮管连接对应接口后,倒置盛稀硫酸的试管。
①样品和稀硫酸应分别置于________、_________仪器中(填“甲”或“乙”),甲、乙试管中接口的连接方式为:A连接_______,B连接_______,C连接F(填各接口的编号)。
②量气管可以用化学实验室中一种常用仪器来改装,该仪器的名称是___________。当气体不再产生且恢复至室温时,如丙图所示量气管读数______________mL。若量气之前的其他操作均正确,根据该读数并将产生的气体体积换算为标准状况后,所计算样品中铁的质量分数将__________(填“偏大”、“偏小”或“无影响”),原因是______(若无影响该空不必作答)。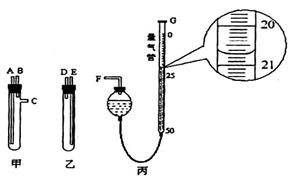
(17分)工业上煅烧黄铜矿(CuFeS2)冶炼铜并得到碱式硫酸铁[Fe(OH)SO4]等其他重要化合物,主要流程如下(部分反应物和产物未标出):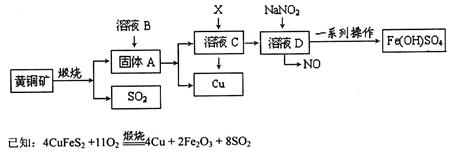
(1)溶液B是_____________________;X是__________________________________。
(2)某同学取溶液C滴入KSCN溶液,溶液不变红,说明溶液C中不含Fe3+,其原因是________(用简单的文字和离子方程式说明):再向该溶液中滴入H2O2溶液,溶液变红色。则滴入H2O2溶液发生反应的离子方程式为___________________。
(3)在溶液D与NaNO2的反应中,常采用同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作____________,如参加反应的O2有11.2L(标况),则相当于节约NaNO2物质的量为______________mol。
(4)该法得到的金属铜中常含有金、银、铁、镍等金属杂质,常用电解精炼的方法得到纯铜,请在右边框内画出其原理装置示意图。
(5)[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,它溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为____________。
MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、 MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:
按要求回答下列问题
(1)第②步操作中,氧化性强弱顺序:ClO3-______MnO2(填“>”“<”),当NaClO3转移2mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________。
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是 。
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是____________(填写一组即可)。工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该反应的阳极反应式为_____________。
草酸晶体的组成可表示为H2C2O4·xH2O。实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4·xH2O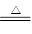 CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
(1)A装置为加热分解草酸的装置,该装置错误是_____________,C装置中盛放的试剂是_______(填化学式),E装置的作用是__________。
(2)实验过程中涉及到如下操作:①点燃A处的酒精灯 ②熄灭A处的酒精灯 ③点燃D处的酒精灯 ④熄灭D处的酒精灯。这4步操作由先到后的顺序为________(填序号)。点燃D处酒精灯前必须要进行的操作名称是__________。
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值。
实验步骤:准确称取1.17g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL。滴定时,所发生的反应为:2MnO4-+5H2C2O4+6H+ = 10CO2+2Mn2++8H2O。
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有_____________。
②x=________。
(4)为探究催化剂对化学反应速率的影响,在甲乙试管中分别加入下列物质
| 试管 |
0.01mol/L KMnO4 |
0.1mol/L H2C2O4 |
0.1mol/L H2SO4 |
MnSO4固体 |
| 甲 |
4 mL |
x mL |
1 mL |
无 |
| 乙 |
y mL |
2mL |
1 mL |
有 |
则x=_______,y=________。能够得出催化剂对该反应有影响结论的实验现象是_____________。
与
的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
(1)仪器
的名称是。安装
中导管时,应选用图2中的。
(2)打开
的活塞,A中发生反应:
+
=
↑+
↑+
+
。
为使
在
中被稳定剂充分吸收,滴加稀盐酸的速度宜(填"快"或"慢")。
(3)关闭
的活塞,
在
中被稳定剂完全吸收生成
,此时
中溶液的颜色不变,则装置
的作用是。
(4)已知在酸性条件下NaClO2可发生反应生成
并释放出
,该反应的离子方程式为,在
释放实验中,打开
的活塞,
中发生反应,则装置
的作用是。
(5)已吸收
气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放
的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是,原因是。