降低大气中CO2的含量、减缓温室效十分重要。
(1)工业上有一种方法是用CO2来生产甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 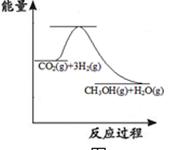
上图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。该反应是 (填“吸热”或“放热”)反应。
(2)某温度下,若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如下图实线所示。则加入催化剂的曲线是 (填:a或b);
0—8min内该反应的平均速率v(CO2)= mol/(L·min)。
(3)在CO跟O2的反应中,破坏1molCO中的化学键消耗的能量为a kJ,破坏1molO=O键消耗的能量为bkJ,形成1molC=O键释放的能量为ckJ。则1molCO在空气中完全燃烧生成CO2放出的能量为
kJ。
Ⅰ恒温、恒压下,在一个可变容积的容器中发生如下反应: A(气)+B(气) C(气)。
C(气)。
(1)若开始时放入1 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的量为 mol,
(2)若开始时放入3 mol A和3 mol B,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x mol A、2 mol B和1 mol C,到达平衡后,A和C的物质的量分别是y mol和3a mol,则x= mol,y= mol。平衡时,B的物质的量 (选填一个编号)。
(甲)大于2 mol(乙)等于2 mol
(丙)小于2 mol(丁)可能大于、等于或小于2 mol
Ⅱ若维持温度不变,在一个与(Ⅰ)反应前起始体积相同、且容积固定的容器中发生上述反应。
(4)开始加入1 mol A和1mol B 时A的转化率为m,若开始时加入1 mol A和2 mol B 时A的转化率为n,则m n(“>”、“<”、“=”)
(5)开始时放入1 mol A和1 mol B到达平衡后生成b mol C。将b与(1)小题中的a进行比较____(选填一个编号)。
(甲)a<b(乙)a>b(丙)a="b" (丁)不能比较a和b的大小
氯气在298K、100kPa时,在1L水中溶解0.09mol即达饱和,实验测得溶于水的Cl2有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为_____ _____; 计算上述体系的平衡常数_____ 。
(2)若在该饱和氯水中①加入少量NaOH固体,平衡将向________移动,溶液的pH值将 (“增大”、 “减小”、“不变”);②通入适量氯气平衡将________移动。(填“向左”、“向右”、“不移动”)
(3)如果增大氯气的压强,平衡将向_________移动(填“左”、“右”)。氯气在水中的溶解度将______。(填“增大”、“减小”或“不变”),参与反应的氯气与溶解氯气的比值将______1/3(填“大于”、“小于”或“等于”)。
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期。A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子。请回答下列问题:
(1)A、B、C三种元素第一电离能最大的是(填元素符号)______,基态E原子的电子排布式为______。
(2)C、D的简单氢化物中沸点较高的是__________(填分子式),原因是____________。
(3)A元素可形成多种单质,其中分子晶体的分子式为______________,原子晶体的名称是 ;A的一种单质为层状结构的晶体(如图),其原子的杂化轨道类型为______________。
(4)①化合物DC2的立体构型为______________,中心原子的价层电子对数为 。
②用KMn04酸性溶液吸收DC2气体时,MnO4-被还原为Mn2+,该反应的离子方程式为______________。
(5)D与E能形成化合物X,X的一种晶体晶胞结构如图所示,X的化学式为 ,E的配位数为________________;若晶胞边长为a,则晶体E的密度计算式为ρ= 。
向恒容密闭容器中充入2.0 mol A和3.0 mol B,发生反应xA(g)+2B(g)  yC(g)。恒温下反应10 min后突然改变某一条件,12 min时达到化学平衡状态I;18 min时升高温度,22 min时达到化学平衡状态II。容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
yC(g)。恒温下反应10 min后突然改变某一条件,12 min时达到化学平衡状态I;18 min时升高温度,22 min时达到化学平衡状态II。容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
(1)从反应开始到10 min时,该反应的平均速率v(A)= ;平衡状态I时,反应物A的转化率a(A)=__________。x:y=__________。
(2)容器内的压强:平衡状态I与起始状态相比较是__________(选填“增大”、“减小”、 “相等”或“无法判断”),逆反应为___________反应(选填“放热”或“吸热”)。
(3)推测第10 min时改变的反应条件可能是___________(选填编号)。
①减压 ②降温 ③升温 ④加催化剂 ⑤增加B的量 ⑥充入氦气
(4)若已知平衡状态I时B的物质的量为0.6 mol,平衡状态I和平衡状态Ⅱ时该反应的平衡常数分别为K1和K2。则Kl=_ ,且K1__________K2(选填“>”、“<”或“=”)。
将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到 224 mLCO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液。向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如右图所示。
(1)由图可知,固体M与稀硫酸反应后所得溶液中除含有溶质MgSO4和Al2 (SO4)3外,还含有的溶质的物质的量是 mol。
(2)M的化学式为 。