草酸(H2C2O4)是二元中强酸,酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。
Ⅰ、某探究小组利用该反应,用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的离子方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。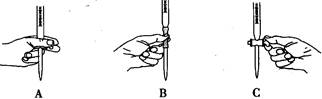
(3)本滴定达到终点的标志是: ;
(4)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度 ,(填“偏高”、“偏低”、或“不变”)。
Ⅱ、草酸氢钠溶液显酸性,常温下,向10 mL 0.01mol/LNaHC2O4溶液中滴加0.01mol/LNaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是: 。
| A.V(NaOH)=0时,c(H+)= 1×10-2 mol/L |
| B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)= 1×10-7 mol/L |
| D.V(NaOH)>10mL时, c(Na+)> c(C2O42-)> c(HC2O4-) |
有一瓶溶液只含Cl-、CO32—、SO42—、Na+、NH4+、K+、Mg2+七种离子中的某几种。经实验:
①原溶液 白色沉淀;
白色沉淀; ②将①所得溶液
②将①所得溶液 放出使湿润的红色石蕊试纸变蓝的气体;
放出使湿润的红色石蕊试纸变蓝的气体; ③原溶液
③原溶液 中加BaCl2溶液不产生沉淀。
中加BaCl2溶液不产生沉淀。 ④原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
④原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。 回答下列问题:
回答下列问题: (1) 试分析原溶液中一定含有的离子是,一定不含
(1) 试分析原溶液中一定含有的离子是,一定不含 有的离子是,可能含有的离子是。
有的离子是,可能含有的离子是。 (2) 有同学认为实验④可以省略,你认为呢?(填“可以”或“不可以”),
(2) 有同学认为实验④可以省略,你认为呢?(填“可以”或“不可以”), 并说明理由。
并说明理由。
(
有以下几种物质
| A.氯化钠 | B.硫酸(H2SO4) | C.醋酸(CH3COOH) | D.氯化银 E、酒精 F、蔗糖 |
G、氨气 H、二氧化硫 I、铜 J、硫酸钡 K、硝酸钠溶液 L、氢氧化铜
M、食盐水 N、石墨
请填空回答(填序号)。
(1)以上物质中能导电的是;
(2)以上物质中属于电解质的是;
(3)以上物质中属于非电解质的是;
(4)以上物质中既不属于电解质又不属于非电解质的是.
(每空2分共8分)
向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(g)+ 3 H2(g) 2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
①.若a=0,b=0,则c=
②.若a=0.7,b=2.1,则:
Ⅰ.c=.
Ⅱ.这时反应向进行.
Ⅲ.若要维持反应开始向该反应方向进行,c的范围是
(每空2分共10分)
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)若增大压强,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则B的转化率_________。
(4) 若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______。
某次发射火箭,用N2H4(g)(肼)在NO2中燃烧,生成N2、液态H2O。已知:①N2(g)+2O2(g) ===2NO2(g) △H1="+67.2kJ/mol"
②N2H4(g)+O2(g) ===N2(g)+2H2O(l) △H2="-534kJ/mol"
假如都在相同状态下,请写出发射火箭反应的热化学方程式:__________________