工业上可以利用含铝、铁、铜合金的废料获得的绿矾(FeSO4·7H2O)、胆矾等,甲同学设计的实验方案如下: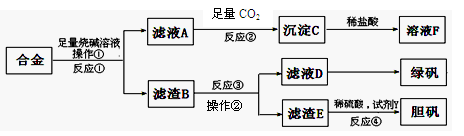
请回答:
(1)操作①、操作②所用的玻璃仪器是 ;沉淀C的化学式为 。
(2)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选) 。
(3)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 。
(4)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和H2O2制胆矾晶体,则反应④的离子化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L HNO3,欲使3mol Cu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L。
(10分)短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D与B属于同一族元素。
(1)元素:A为________,D的质子数和中子数相等,D的原子组成符号为:_________,
它的最高价氧化物对应的水化物为:________。
(2)用电子式表示A、B两元素形成AB2的过程_____________________________
用电子式表示C、D两元素形成化学键的过程_______________________________
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察右图,然后回答问题。
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应_____________(填“需要”或“不需要”)加热,该反应的△H =_________________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+ O2(g) = H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
H2O(g) △H =-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为____________________。
为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
| 编号 |
电极材料 |
电解质溶液 |
电子流向 |
| ① |
Mg—Al |
HNO3(浓) |
Mg→Al |
| ② |
Mg—Al |
HCl(aq) |
Mg→Al |
| ③ |
Mg—Al |
NaOH(aq) |
Al→Mg |
| ④ |
Al—Cu |
HNO3(浓) |
Cu→Al |
根据以上表格内容回答:
(1)实验1中Mg作___________(填正极或负极),发生__________(氧化反应或还原反应)
实验3中Mg作___________,发生__________(同上)
(2)实验2中Mg电极反应式为__________________。Al电极上的电极反应式为_________________________,总的电池反应是______________________________。
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图,依图所示: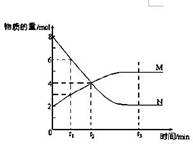
(1)该反应的化学方程式是___________________。
(2)在图上所示的三个时刻中,(填t1、t2或t3)时刻处于平衡状态,此时V正V逆(填>、<或=);达到平衡状态后,平均反应速率v(N)﹕v(M)= 。
(3)若反应容器的容积不变,则压强不再改变(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率
| A.升高温度 | B.降低压强 | C.减小M的浓度 | D.将反应容器体积缩小 |
有机化学中常用18O原子作示踪原子来研究乙酸与乙醇反应生成酯的反应机理,反应过程中酸分子断裂C—O单键,醇分子断裂O—H键。试述书写CH3COOH和CH3CH218OH反应的化学方程式:
已知反应: KClO3 + 6HCl =" KCl" + 3Cl2 + 3H2O ,若用K35ClO3与H37Cl作用,则所得氯气的相对分子质量为 .