【化学——选修3物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。( )
)
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。

(1)写出下列物质的化学式;乙;B 。
。
(2)写出3反应的化学方程式。
(3)写出2反应的离子方程式:。
Ⅰ、除去下列物质中所混有的少量杂质,写出有关的反应方程式。
(1)铜粉中混有少量铝粉;
(2) FeCl3中混有少量FeCl2;
(3)Na2CO3固体中混有少量NaHCO3。
Ⅱ、氯气溶于水发生反应,写出其化学方程式。某学生为了探究氯水的成分,请你与他一起完成探究过 程,并书写实验报告。
程,并书写实验报告。
| 实验步骤 |
操作方法 |
实验现象 |
结论或解释 |
| 1 |
观察氯水的颜色 |
含有Cl2 |
|
| 2 |
有无色气体产生 |
含有H+ |
|
| 3 |
取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 |
有白色沉淀生成 |
|
| 4 |
取少量氯水于试管中,放入红色布条 |
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。
在每次实验时,记录图中电压表指针的移动方向和电压表的读数如下:
| 金属 |
电子流动方向 |
电压/V |
| A |
A→Cu |
+0.78 |
| B |
Cu→B |
-0.15 |
| C |
C→Cu |
+1.35 |
| D |
D→Cu |
+0.30 |
已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
请根据表中数据回答下列问题。
(1)__________金属可能是最强的还原剂;_______金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润, 则在滤纸上能看到有蓝色沉淀析出的金属是__________(填字母)。其对应电池的电极反应式为:
则在滤纸上能看到有蓝色沉淀析出的金属是__________(填字母)。其对应电池的电极反应式为:
负极: _______________________;正极: ________________________。
有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A 2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1) A2B2的电子式为____________。
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1 L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)。
在b电极上发生的反应可表示为:PbO2+4H++SO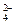 +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
(3)金属元素E是中学化学常见元 素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反
素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反 应的离子方程式为____________________________________。
应的离子方程式为____________________________________。
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为______________________________。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是___________________________________。
(12分)A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1) )画出D元素的原子结构示意图____ ________。
________。
(2)与E的氢化物分子所含电子总数相等的分子是____________(举一例、填化学式,下同)、阳离子是____________、阴离子是。
(3) B的最高价氧化物对应的水化物中含有化学键的类型是____________。
(4) D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为__________________________________________。