现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作:
(1)操作①名称是 ,操作②名称是 (过滤/萃取/分液/蒸馏/溶解/结晶);
(2)溶液B是 ,沉淀C是 (AlCl3/ FeCl3/ Al(OH)3/ Fe(OH)3/ NaAlO2);
(3)若往溶液A中滴入KSCN溶液,预计会观察到溶液呈 色;
(4)下图所示仪器中,操作②需要用到的仪器是 (填仪器的名称);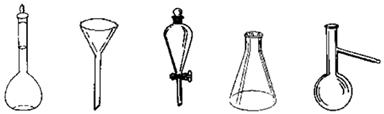
(5)请写出在溶液中,FeCl3和NaOH反应的化学方程式:
实验题
在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右。维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸。某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,请完成下面的测定实验分析报告。
(一)测定目的:测定××牌软包装橙汁中维生素C的含量。
(二)测定原理:C6H8O6+I2 →C6H6O6+2H++2I―
(三)实验用品及试剂:仪器和用品(自选,略)
试剂:指示剂 ① (填名称),浓度为7.50×10-3mol·L-1的I2标准溶液、蒸馏水等。
(四)实验过程
(1)洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
(2)用 ② (填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(3)用左手控制滴定管的 ③ (填部位),右手摇动锥形瓶,眼睛注视 ④ ,直到滴定终点。滴定至终点时的现象是 ⑤ 。
(4)数据记录与处理:若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是 ⑥ mg/L。
(五)问题讨论:从分析数据看,此软包装橙汁是否是纯天然橙汁? ⑦ (填“是”或“不是”或“可能是”)。制造商最可能采取的做法是 ⑧ (填编号):
A.加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1) 烧瓶底部放置了几片碎瓷片,
碎瓷片的作用是 。
装置B中发生反应的化学方程式是____________________________ ____。
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,装置E中的现象是_ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。
简述检验滤液中Fe3+的操作方法____________________________。
(4) 该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
步骤I中通入Cl2的作用是________________________________。
研究性学习小组探究金属锈蚀的条件,进行如下对照实验:
(1)数天后铁钉明显锈蚀的装置是 ;
(2)铁制品锈蚀的条件是 ;
(3)铁钉生锈主要属于 腐蚀(填“化学”或“电化学”);
化学小组同学依据化学反应Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与110 mL 98%的浓H2SO4充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。(F中为无水硫酸铜)
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与110 mL 98%的浓H2SO4充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。(F中为无水硫酸铜)
请回答下列问题:
(1)装置A中添加液体的仪器名称为 ; 98%的浓H2SO4(ρ=1.84 g/cm3)的物质的量浓度是 ;
(2)装置B是为了吸收SO2,则不能选用下列试剂中的 (填序号);
A.NaOH溶液 B.浓H2SO4 C.KMnO4溶液
(3)装置D的作用是 ;
(4)可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有氢气的实验现象是 。
(1)用天平称取________g NaOH配制500 mL 2.0 mol·L-1的溶液时,除了烧杯、玻璃棒外,还要使用的玻璃仪器是 。
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是 。