运用化学反应原理研究碳的化合物具有重要意义。
(1)常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s) 5CO2(g)+I2(s) △H<0。向2L密闭容器中加入足量I2O5(s),并通人1molCO,CO2的体积分数
5CO2(g)+I2(s) △H<0。向2L密闭容器中加入足量I2O5(s),并通人1molCO,CO2的体积分数 随时间的变化如下图所示:
随时间的变化如下图所示:
①0~0.5min内的平均反应速率v(CO)= _____________。
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是______。
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中CO2的体积分数 ,可采取的措施为____________。
,可采取的措施为____________。
(2)以 为催化剂,可以将
为催化剂,可以将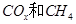 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。
①若该反应的原子利用率为100%,则 ______________。
______________。
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则: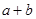 _____14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
_____14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)利用反应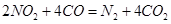 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
0.6 mol O2和0.4 mol臭氧(O3)的质量________(填“相等”或“不相等”,下同),它们所含的分子数__________,所含的氧原子数___________。
(10)[物质结构].甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学程式是___________________________________
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:___________________________________
(3)在一定条件下,甲与O2反应的化学方程式是_______________________
(4)丁的元素符号是_________,它的核外电子排布式为_______________________
(5)丁的氧化物的晶体结构与_________________的晶体结构相似。
有机物A(分子式C6H10O3)是合成某种隐形眼镜材料的单体,A可发生如下变化:
已知:Ⅰ.物质B是最简单的二元醇,可用作汽车发动机抗冻剂;物质D不能发生银镜反应,但能与NaHCO3溶液反应放出气体。
Ⅱ.
回答下列问题:
(1)隐形眼镜材料的结构简式为;
(2)写出物质B在铜催化下与O2反应的化学方程式;
(3)与C互为同分异构体,分子为链状的酯类物质共有种;
(4)请设计合理方案,用物质D制取乙二酸(其他无机原料自选,用反应流程图表示,并注明必要的反应条件)。
例如:
将a mol的Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(1)当剩余固体为Na2CO3,排出气体为O2,H2O时,a与b的比值为________.
(2)当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,a与b的比值为________.
(3)当a大于b时,剩余固体为________,排出气体为________.
(4)排出的O2和H2O为等物质的量时,则a与b的比值为________.
(11)下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。
根据图示回答问题:
(1)写出下列物质的化学式:A_________,E_________ ,I_____________;
(2)反应①的化学方程式是______________________________;
反应②的化学方程式是_______________________;
(3)J与盐酸反应的化学方程式是__________________________;
反应后的溶液与D反应的化学方程式是__________________________________。