化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。Ⅰ可以用E和H在一定条件下合成: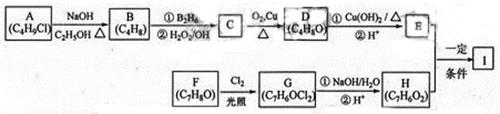
已知以下信息:
A的核磁共振氢谱表明其只有一种化学环境的氢;
化合物F苯环上的一氯代物只有两种;
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为_________。
(2)D的结构简式为_________。
(3)E的分子式为___________。
(4)F生成G的化学方程式为________,该反应类型为__________。
(5)I的结构简式为___________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式______。
右图中每一方框的字母代表一种反应物或生成物。
已知气态烃D(其密度在同温同压下是氢气密度的13倍)跟物质F反应时产生明亮而带浓烈黑烟的火焰。请写出下列字母代表的物质的化学式(分子式):
A 、B 、E 。
在用稀盐酸和氢氧化钠溶液进行中和反应的实验时,反应过程中溶液的酸碱度变化如图所示。
(1)该反应的化学方程式____________________________.
(2)该实验操作是将_______________滴加到___________另一种溶液中。
(3)当加入溶液的质量为ag时,所得溶液中的溶质为______________(写化学式)。
(4)当加入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液呈_____________色。
工业上制取CuSO4,不是直接用浓H2SO4与铜加热的条件下反应,而是将铜丝浸入稀H2SO4中并不断的由容器的下部吹入细小的空气泡。试分析这种制取方法的优点是______。
在25℃时若10体积某强酸溶液与1体积的某强碱溶液混合后溶液是碱性,则混合前,该强酸的溶液的pHX与该强碱溶液的pHY之间应满足的关系是______。
对复杂的有机物的结构可用“键线式”简化表示,如苯丙烯酸丙烯酯:
可简化为: ,杀虫剂“阿乐丹”的结构表示为:
,杀虫剂“阿乐丹”的结构表示为:
(1)它的化学式为______。
(2)若它在稀酸作用下能生成两种有机物,这两种有机物可能有的共同性质是
| A.遇FeCl3溶液均显紫色 |
| B.均与NaOH溶液反应 |
| C.在一定条件下均与H2反应 |
| D.均能与溴水发生加成反应 |