黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应: 2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
(1)二氧化硅与碳高温下反应的化学方程式为
上述反应中生成的单质有什么用途: (写一条即可)。卞石是硅酸盐,不同类型的卞石中氧原子的物质的量分数相同,由钠卞石化学式NaAlSi3O8可推知钙卞石的化学式为 ,请将钠卞石的化学式改写成氧化物的形式:
(2)天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
COS Na2S溶液
Na2S溶液 H2羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
H2羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
(1)如图所示为硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30 ℃前后对应不同的晶体),从图中获取如下信息,不正确的有 (填字母)。
a.C点溶液为Cu(NO3)2的不饱和溶液
b.30℃时结晶可析出两种晶体
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.将A点溶液升温至30 ℃时,可以析出
Cu(NO3)2·3H2O晶体
(2)某些共价化合物(如H2O、NH3、N2O4等)在液态时发生了微弱的电离,如:
2H2O OH-+H3O+,则液态NH3电离的方程式是
OH-+H3O+,则液态NH3电离的方程式是
(3)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g) CO2(g) + 3H2(g)
CO2(g) + 3H2(g) H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
该条件下反应达平衡状态的依据是(填序号) 。
| A.v正(CH3OH)=v正(CO2) |
| B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) |
| D.混合气体的总物质的量不变 |
(4) 甲、乙两容器体积相等,甲容器通入1 mol SO2和1 mol O2,乙容器通入1 mol SO3和0.5 mol O2,发生反应:2SO2(g) + O2 (g)  2SO3(g)
2SO3(g) H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
(5)甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。下图是甲醇燃料电池模型,试回答下列问题:
①写出该燃料电池的负极反应式 。
②空气应该从 (选a、b、c、d)通入。 M、N是阴离子交换膜,则阴离子移动的方向是 (填“从左到右”或“从右到左”)
(6)含Al3+的盐常用作净水剂,用离子方程式表示其净水原理_________。
(1)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在abc装置中能保护铁的是 (填字母)
②若用d装置保护铁,X极的电极材料应是 (填名称)
 |
(2)25℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe (OH)3]=2.64×10-39
25℃时,向含有Mg2+,Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ·mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ·mol-1
(3)已知:①Fe2O3(s)+ 3C(石墨) = 2Fe(s)+3CO(g)ΔH1=" +" 489.0 kJ·mol-1
②C(石墨)+CO2(g)= 2CO(g)ΔH2 =" +" 172.5 kJ·mol-1则a = kJ·mol-1。
(4)冶炼铁反应的平衡常数表达式K = ,温度升高后,K值 (填“增大”、“不变”或“减小”)。
(5)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 |
CO[ |
Fe |
CO2 |
|
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
2.0 |
1.0 |
1.0] |
① 甲容器中CO的平衡转化率为 。
② 下列说法正确的是 (填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2∶3
同学们,我们学习过的化学反应有很多了,让我们对所学过的化学反应方程式做个总结吧!有一些化学反应可用下式表示
A + B ─→ C + D + H2O
请你根据下面的提示回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程
式: 。
(2)若C为能使酚酞溶液变红的气体,则实验室制备C的方程式为 。
(3)若A为Na2O2,B为硫酸,则C和D的化学式是 。
(4)若A为红色固体,D能使品红褪色,反应的化学方程式为: 。
(5)若A非金属为单质,B为第二周期某种元素的最高价氧化物的水化物,请写出符合上式的化学方程式: 。
【化学—选修3:物质结构与性质】
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是_______,基态Cr原子的价电子排布式是_____。
(2)用“>”或“<”填空:
| 第一电离能 |
键能 |
沸点 |
离子半径 |
| Be_____B |
C—C_____Si—Si |
H2S_____H2O |
Al3+_____O2- |
(3)BeCl2分子的空间构型是______,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是_____。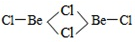

(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式______。
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg·cm-3,则晶胞连长为___cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示)。