I.甲、乙、丙、丁四种物质存在转化关系:

(1)若甲、乙均为空气主要成分,则丁与水反应的化学方程式为 。
(2)若甲为常见的固体非金属单质,丙可使品红溶液褪色,则丁为____________。
(3)若乙是生活常见金属单质,丙→丁的离子方程式为 。
(4)若丙既能与强酸又能与强碱反应,则丙的化学式为 (任写1种)。
II.一定温度下,容积为1 L的密闭容器中投入0.5 mol PCl5(g),存在平衡:PCl5(g) PCl3(g)+ Cl2(g)。反应过程中测得部分数据如下表:
PCl3(g)+ Cl2(g)。反应过程中测得部分数据如下表:
| 时间 |
n(PCl5)/mol |
n(PCl3)/mol |
n(Cl2)/mol |
| 0 |
0.5 |
0 |
0 |
| t1 |
0.45 |
|
|
| t2 |
|
0.1 |
|
| t3 |
0.4 |
|
|
(5)t1时刻,测得反应吸收的热量为a kJ。PCl3(g)与Cl2(g)反应的热化学反应方程式为 。
(6)t2时:v正 v逆(填“>”、“<”或“=”)。
(7)计算该反应的化学平衡常数K=_____________。相同温度下,改为往容器中投入0.2 mol PCl5(g)、0.2 mol PCl3(g)、0.1 mol Cl2(g),到达平衡前,PCl5的物质的量将 (填“增大”、“减小”、“不变”)。
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,电极均为石墨电极。闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题: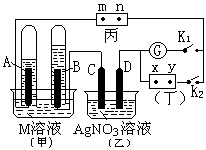
(1)M溶液可能是(填序号)。
A.KNO3溶液B. Ba(OH)2溶液 C.H2SO4溶液
D. NaCl溶液 E.CuSO4溶液
(2)X为电源极,m点的现象。
(3)C极的电极反应式为。
(4)若乙池中AgNO3溶液电解后体积为100mL,测得溶液的pH=1, 则乙池中C极析出的固体质量为g。
(5)继续电解一段时间后,甲池中A、B极均部分被气体包围,此时闭合K1,断开K2,发现A、B极的管内气体体积减少,且电流计G指针发生偏转,则A极电极反应式为。
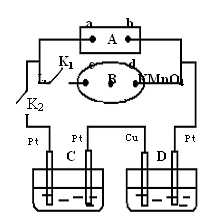
如下图所示,A、E为石墨电极,B、F为铁片电极。按要求回答下列问题。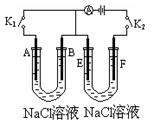
(1)打开K2,合并K1。B为极,A的电极反应为,最终可观察到的现象是,
涉及的化学反应方程式有:
。
(2)打开K1,合并K2。
F为极,F极的电极反应为,
电解过程中,观察到溶液的现象是。
电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,若用硫酸铜溶液作电解液,粗铜接电源 极,电极反应为 ;通电一段时间后,溶液中铜离子浓度将 (增大,不变,减少)。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总离子反应
式为 ;电解时所需的精制食盐水,通常在粗盐水
加入某些试剂(现提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液来、BaCl2
溶液、Ba(NO3)2溶液、盐酸)除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,选出试剂,
按滴加的先后顺序为 (填所加试剂的化学式)。
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离
子交换膜法电解饱和食盐水原理示意图。
|
下列说法中正确的是
| A.从E口逸出的气体是H2 |
| B.从B中加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4L Cl2,便产生2mol NaOH |
| D.向电解后的阴极溶液中加适量盐酸,可以 |
恢复到电解前的物质的浓度
如右图所示,常温下电解5 min后,铜电极质量增加2.16g。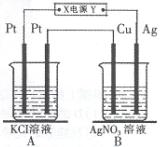
试回答:
(1)电源电极X名称为(填“正极”或“负极”),B中铜电极的名称。
(2)电解池B中阳极的电极反应式是。
(3)若A中KCl溶液的体积是200mL,电解后溶液的
PH=(忽略电解前后溶液体积的变化)。
若要使电解后的溶液恢复到与电解前完全相同,应
加入。
电解原理在化学工业中有广泛应用。右图表示一个电解池,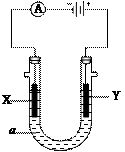
装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同
时在两边各滴入几滴酚酞试液,则
①Y电极上的电极反应式为,
检验该电极反应产物的方法是。
②电解池中X极上的电极反应式为。
在X极附近观察到的现象是。
③电解一段时间后,若收集到H2为2L,则同样条件下收集的Cl22L(填“>”“<”“=”),
原因是。
(2)如果在铁件的表面镀铜防止铁被腐蚀,电解液a选用CuSO4溶液,请回答:
①X电极对应的金属是______(写元素名称),其电极反应式。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二
者质量差为5.12 g,则电镀时电路中通过的电子为________________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。