(本题共13分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,为白色或黄色结晶粉末或小结晶,带有强烈的SO2气味,溶于水即生成NaHSO3。实验室可利用二氧化硫与亚硫酸钠反应制备焦亚硫酸钠。某研究小组进行如下实验:实验一:焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有黄色晶体析出。
33.装置I中产生气体的化学方程式为 。
34.要从装置II中获得已析出的晶体,在实验室中需要使用到的玻璃仪器是: 。
35.装置III用于处理尾气,防止污染环境。下列装置中,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
实验二:焦亚硫酸钠的性质
36.将Na2S2O5溶于水配成溶液,
(1)欲证明所得溶液中的离子浓度大小关系:c(SO32—)>c(H2SO3),下列选项中可采用的实验方法是 。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
f.加入BaCl2溶液
(2)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三:葡萄酒中抗氧化剂残留量的测定
37.葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
(15分)某工厂回收电镀污泥[主要成分为Cu(OH)2、Ni(OH)2、Fe(OH)2、Al(OH)3和砂土]中的铜和镍,工艺流程如下:
(1)下列措施中,可提高步骤①浸出速率的是___________。
a.加热
b.增大压强
c.延长浸出时间
d.适当提高硫酸的浓度
e.及时分离出产物
(2)步骤②电解过程中铜粉在_______(填“阴"或“阳”)极产生。若始终没有观察到气体生成,则该电解过程的离子方程式为_______。
(3)已知FePO4、.A1PO4、Ni3(PO4)2的Kap分别为1.0 x l0-22、1.0 x l0-19、4.0 x 10-31,步骤 ②所得溶液中c(Ni2+)为O.1 mo1·L-1。步骤③反应后溶液中c(PO43-)理论上应控制的范围是_____ mo1·L-1 (离子浓度小于1O-5 mo1·L-1可视为沉淀完全)。
(4)步骤④的萃取原理为[注:(HA)2为有机萃取剂]
NiSO4(水层)+2(HA)2(有机层)  Ni(HA2)2(有机层)+H2SO4(水层)
Ni(HA2)2(有机层)+H2SO4(水层)
为促使上述平衡向正反应方向移动,可采取的具体措施是_____(写一条即可)。
(5)步骤⑤中作为反萃取剂的最佳试剂为_____(填名称)。
(6)该工艺流程中,可以循环使用的物质有______。
(15分)节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。实验小组同学欲测定空气中SO2的含量,并探究SO2的性质。
I.某实验小组同学拟用下图所示简易装置测定空气中SO2的含量。
实验操作如下:按图连接好仪器,检查装置气密性后,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+ H2O2=H2S04)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.233mg。
(1)计算所测空气中SO2含量为_______mg·L-1。
(2)已知常温下BaS03的Ksp为5.48x10-7,饱和亚硫酸溶液中c(S032-)=6.3x10-8{mol·L-1。
有同学认为以上实验不必用H2O2吸收SO2,直接用O.1mol·L-1BaCl2溶液来吸收S02即可产生沉淀。请用以上数据分析这样做是否可行________________.
U.另一实验小组同学依据SO2具有还原性,推测SO2能被C12氧化生成SO2C12。
用如图所示装置收集满C12,再通入SO2,集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究。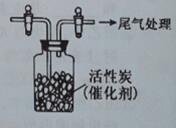
(3)写出二氧化锰和浓盐酸反应制取氯气的离子方程式____________________.
(4)研究反应的产物。向所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有S042-、C1-,证明无色液体是SO2C12。
写出SO2C12与H2O反应的化学方程式_______________________________________.
(5)研究反应进行的程度。用NaOH溶液吸收分离出的气体,用盐酸酸化后,再滴加BaCl2溶液。产生白色沉淀。
①该白色沉淀的成分是_____________.
②SO2和C12生成SO2C12的反应________可逆反应(填“是”或“不是”),阐述理由___________.
镍行业发展蕴藏着巨大的潜力。某小组用废镍催化剂(成分为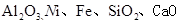 等)制备草酸镍晶体(NiC2O4·2H2O)的部分实验流程如下:
等)制备草酸镍晶体(NiC2O4·2H2O)的部分实验流程如下: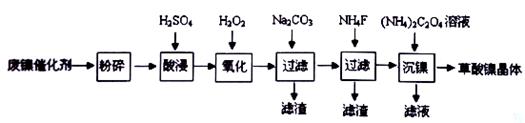
(1)“粉碎”的目的是______________________________________________.
(2)实验过程中多次进行过滤。过滤操作中,除需用到玻璃棒、烧杯外,还需用到的玻璃仪器有_______.
(3)保持其他条件相同。在不同温度下对废镍催化剂进行”酸浸”。镍浸出率随时间变化如图。以下四个选项中最适宜的条件是____________(填字母)。
a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(4)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是______________________________.
(5)草酸镍晶体(NiC2O4·2H2O)在热空气中干燥;脱水后,再隔绝空气高温煅烧3小时,制得三氧化二镍,同时获得一种混合气体。写出草酸镍(NiC2O4。)高温分解的化学方程式________________.
(6)工业上还可用电解法制取三氧化二镍。电解过程中产生的CIO-把二价镍氧化为三价镍。
写出C10-氧化Ni(OH)2生成三氧化二镍的离子方程式__________________________________.
(7)用1000g废镍催化剂(镍含量为a%),理论上可制备草酸镍晶体的质量为________g(只列式不计算。已知:NiC2O4·2H2O的相对分子质量为183)。
实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下: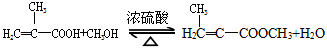
| 药品 |
相对分子质量 |
熔点/℃ |
沸点/℃ |
溶解性 |
密度(g•cm-3) |
| 甲醇 |
32 |
-98 |
-64.5 |
与水混溶,易溶于有机溶剂 |
0.79 |
| 甲基丙烯酸 |
86 |
15 |
161 |
溶于热水,易溶于有机剂 |
1.01 |
| 甲基丙烯酸甲酯 |
100 |
-48 |
100 |
微溶于水,易溶于有机溶剂 |
0.944 |
实验步骤:
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是______________________。
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理____________________.但是浓硫酸过多,产率降低,原因是________________________.
(3)上述实验可能生成的副产物结构简式为_______________(填一种即可)
(4)试剂X宜选择_________________.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_______。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是__________.
a.分水器收集的水里含甲酯 b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质 d.产品在洗涤、蒸发过程中有损失
(12分)氢溴酸在医药和石化工业上有广泛用途.图1是模拟工业制备氢溴酸的流程:
回答下列问题:
(1)混合①中发生反应的离子方程式为.
(2)混合②中加入试剂a是.
(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是(请用离子方程式表示).
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+②含Br2③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因.该试剂是(填写字母).
a.KMnO4溶液
b.NaOH溶液
c.KSCN溶液
d.淀粉KI溶液
e.CCl4
(5)实验室制取Br2的反应为:2NaBr+3H2SO4+MnO2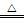 2NaHSO4+MnSO4+Br2↑+2H2O制取Br2最好选用图2装置中的(填写字母,固定和加热装置均已省略).简述检验已选定的图2装置气密性的方法.
2NaHSO4+MnSO4+Br2↑+2H2O制取Br2最好选用图2装置中的(填写字母,固定和加热装置均已省略).简述检验已选定的图2装置气密性的方法.