氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。

请回答下列问题:
(1)氯化铁有多种用途,请用离子方程式表示下列用途的原理。
①氯化铁做净水剂______________________;
②用FeCl3溶液(32%~35%)腐蚀铜印刷线路板_________________________。
(2)吸收剂X的化学式为 ;氧化剂Y的化学式为____________。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因_____ 。
(5)K2FeO4在水溶液中易发生反应:4FeO42+10H2O 4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
4Fe(OH)3+8OH+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
| A.H2O |
| B.稀KOH溶液、异丙醇 |
| C.NH4Cl溶液、异丙醇 |
| D.Fe(NO3)3溶液、异丙醇 |
(6)可用滴定分析法测定粗K2FeO4的纯度,有关反应离子方程式为:
①FeO42-+CrO2-+2H2O CrO42-+Fe(OH)3↓+OH-
CrO42-+Fe(OH)3↓+OH-
②2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
③Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
现称取1.980 g粗高铁酸钾样品溶于适量氢氧化钾溶液中,加入稍过量的KCrO2,充分反应后过滤滤液定容于250 mL容量瓶中。每次取25.00 mL加入稀硫酸酸化,用0.1000 mol/L的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中高铁酸钾的质量分数为 。
(10分)甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,A和B都极易溶于水,用玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白烟。各物质之间存在如下图所示的转化关系: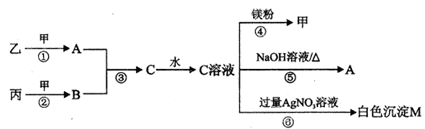
请回答下列问题:
(1)丙与A反应生成乙和C的化学反应方程式为——————
(2)向0.1 mol/L的C溶液中通入A至显中性,溶液中各离子浓度由大到小的顺序为:__________.
(3)常温下取M的饱和溶液与AgI的饱和溶液等体积混合,再加入足量的AgNO3浓溶液发生反应,则生成沉淀的物质的量较多的是________。(填化学式)
(4)电解尿素[CO(NH2)2]的碱性溶液制取甲的装置示意图如右图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极)。 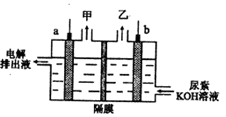
电解时,b极的电极反应是_______。若在a极产生112mL气体(标准状况),则消耗尿素的质量为______g。
(16分)X、Y、Z、E、M、Q、R为七种短周期的主族元素,它们的原子序数依次增大,其中X+无电子,Y、Z同一周期且相邻,X与E、Z与Q分别为同一主族,M的原子序数是Y的2倍,Q的质子数比E多5。J为ds区原子序数最小的元素。请用推断出的元素回答下列问题:
(1)Y、Z、Q三元素的第一电离能由大到小的顺序为__________,Y2、X2分子中共价键的数目之比为_________,MR4分子的中心原子的杂化轨道类型是_______。
(2)由Q、R两元素可按原子个数比l:l组成化合物T,化合物T中各原子均满足8电子的稳定结构,则T的电子式为________。固体化合物E2Z2投人到化合物E2Q的水溶液中,只观察到有沉淀产生,该反应的离子方程式为______________________。
(3)J元素基态原子的外围电子排布式为___________。向JQZ4溶液中逐滴加人Y元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解得到深蓝色的透明溶液,该沉淀溶解的离子方程式是_____________。
(4)J2Z为半导体材料,在其立方晶胞内部有4个Z原子,其余Z原子位于面心和顶点,则该晶胞中有______个J原子。
(14分)化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)  2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示: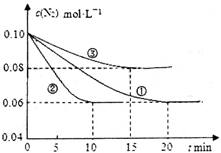
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)="0.05" mol/L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。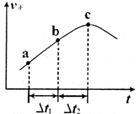
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
(12分)已知两种相邻周期、相邻主族的短周期非金属元素X、Y,其最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题: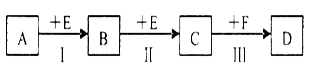
(1)若A、B、C、D均为含X元素的化合物,且A和F的分子均为10电子微粒,则:
①F属于____________(填“离子化合物”或“共价化合物”)。
②反应I的化学方程式为____________________________________________。
③将1.92g铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体1.12L(标准状况),则反应消耗的D的物质的量为________________mol。
(2)若A、B、C、D均为含Y元素的化合物,其中A由两种元素组成,且A的摩尔质量为34 g/mol,则:
①将铜粉与D的浓溶液反应所得溶液加热蒸干,得到的白色固体物质为____________(填化学式)。
②将少景Na2Y溶液滴加到次氯酸钠溶液中发生反应,无沉淀生成,请写出该反应的离子反应方程式__________。在该反应中若有74.5 g NaClO被还原,则转移电子的物质的量为_________mol。
(12分)铝及其化合物用途广泛。工业上焙烧明矾【KAl(SO4)2·12H2O】可得到A12O3,反应的化学方程式为4KAl(SO4)2·12H2O+3S 2K2SO4+2A12O3+9SO2↑+48H2O。
2K2SO4+2A12O3+9SO2↑+48H2O。
请回答下列问题:
(1)在焙烧明矾的反应中,被氧化和被还原的元素质量之比是________________。
(2)焙烧明矾时产生的SO2可用来制硫酸。已知25℃、10lkPa时:
①2SO2(g) +O2(g) 2SO3(g) ΔH=—197KJ/mol
2SO3(g) ΔH=—197KJ/mol
②2H2O(g) 2H2O(l)ΔH=—44KJ/mol
2H2O(l)ΔH=—44KJ/mol
③2SO2(g) +O2(g) + 2H2O(g) 2H2SO4(l)ΔH=—545KJ/mol
2H2SO4(l)ΔH=—545KJ/mol
则反应SO3(g)+ H2O(l)= H2SO4(l)ΔH=______KJ/mol。
(3)工业上利用电解熔融的A12O3制备Al,其化学方程式是_____________________;电解时阳极和阴极材料均为石墨,电解时所消耗的电极是__________(填“阳极”或“阴极”)。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液,可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式为____________;②电池总反应的化学方程式为________________。