空气污染问题日益引起全民关注。工业生产中产生的SO2、NO等为主要污染物。根据你所学化学知识完成下列问题:
Ⅰ.(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物。下列说法不正确的是_________(填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)SO2为重要的含硫化合物,是形成酸雨的主要污染物之一。在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用如图所示气体发生装置中的_______(填下列序号字母)。

(3)为研究SO2的性质,如图在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条火准)。
下列有关说法正确的是___________

| A.蓝色石蕊试纸先变红后褪色 |
| B.湿润的品红试纸、蘸有KMnO4溶液的滤纸均褪色证明SO2具有漂白性 |
| C.湿润的淀粉KI-试纸未变蓝说明SO2的氧化性强于I2 |
| D.NaOH溶液可用于除去实验中多余的SO2 |
(4)一定温度下,在密闭容器中SO2与O2反应生成1molSO3气体时,放出akJ热量。
①该温度下SO2与O2反应的热化学方程式为__________________________。
②已知:2NO(g)+O2(g)═2NO2(g) △H=" -b" kJ•mol-1 (a>b>0)
则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=________________。
Ⅱ.硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需要处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中的二氧化硫的含量,采用以下方案:
实验步骤如下图流程图所示:

(1)步骤①中反应的离子方程式为____________________________。
(2)步骤②中Ba(OH)2是否足量的判断方法是____________________________。
Ⅲ.工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中的反应在酸性条件下进行,写出NO被氧化为NO2-的离子方程式__________。
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示;
图中A为电源的______(填“正”或“负”)极.右侧反应室中发生的主要电极反应式为__________。
(3)已知进人装置Ⅳ的溶液中NO2-的浓度为 0.75mol/L,要使 1m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为_______L。
二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。由于该反应是吸热反应,所以在情况下有利于该反应自发进行
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、;B装置必须放在冰水浴中,其原因是。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:①;②;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2=Na2S4O6 + 2NaI)
①配制100 mL c mol/LNa2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:。
②写出步骤2中发生反应的离子方程式。
③原ClO2溶液的浓度为g / L(用步骤中的字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果。
若滴定开始仰视读数,滴定终点时正确读数,则测定结果。
(填“偏高”“偏低”或“不变” )
暗紫色化合物A具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为;化合物A与H2O反应的离子方程式为。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是
| A.亚硫酸钠 | B.KOH | C.醋酸 | D.Fe(NO3)3 |
(5)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案。
(14分)草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。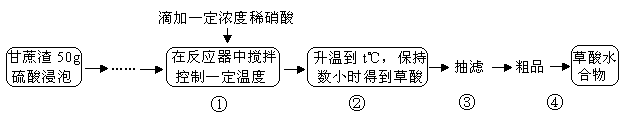
|

三氯化六氨合钴(Ⅲ)是一种重要的化工产品, 实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2CoCl2·6H2O + 10NH3 + 2NH4Cl + H2O2 活性炭2[Co(NH3)6]Cl3+14H2O
已知:① 钴(Ⅱ)与氯化铵和氨水作用,经氧化后一般可生成三种产物:紫红色的二氯化一氯五氨合钴[Co(NH3)5 Cl]Cl2晶体、砖红色的三氯化五氨一水合钴[Co(NH3)5 H2O]Cl3晶体、橙黄色的三氯化六氨合钴[Co(NH3)6]Cl3晶体,控制不同的条件可得不同的产物(如温度不同产物也不同)。293K时,[Co(NH3)6]Cl3在水中的溶解度为0.26mol/L
②CoCl2、[Co(NH3)6]Cl3、[Co(NH3)5 Cl]Cl2在水中能完全电离
③制备三氯化六氨合钴(Ⅲ)粗产品的流程如下:
④三氯化六氨合钴(Ⅲ)粗产品的提纯流程如下:
⑤制备过程中可能用到的部分装置如下:


请回答下列问题:
(1)操作B的名称是 ,操作A后所弃去的沉淀中一定有 。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该反应的离子方程式为。原料NH4Cl的主要作用有:① ;②提供NH3。
(3)冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的:① ;②使反应温和进行。
(4)操作A的名称为 ,进行该操作的装置是(填序号)。
A.装置Ⅰ B.装置Ⅱ C.装置Ⅲ
若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是。
装置Ⅱ中仪器A、B、C、D的名称分别是、、、。
(5)步骤C进行洗涤时要用到两种试剂,应该先用_____(填序号,下同)洗涤,后用 洗涤。
A. 饱和氯化钠溶液 B. 无水乙醇 C. 浓盐酸
(6)你认为本实验提高产率的关键步骤有哪些?。
(7)与[Co(NH3)6]Cl3类似的产品还有[Co(NH3)5Cl]Cl2,请简述验证某晶体是[Co(NH3)6]Cl3还是
[Co(NH3)5Cl]Cl2的实验方案: 。
A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水。请回答下列问题:
(1)B的双原子阴离子电子式为:用化学式表示一种由B、C、E组成的物质。
(2)B的氢化物比E的氢化物的沸点(填“高”或“低”),理由是。
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式。
(4)已知X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,气体甲是天然气的主要成分。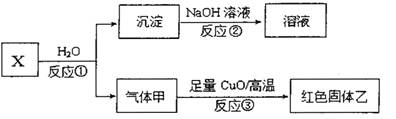
i.写出反应①的化学方程式。
ii.若红色固体乙是一种单质,写出反应③的化学方稈式。
(5)若某气体含有AB2和EB2中的一种或两种,请设计实验方案,探究该气体的成分。