无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为 ;
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:

已知:
| 物质 |
SiCl4 |
AlCl3 |
FeCl3 |
FeCl2 |
| 沸点/℃ |
57.6 |
180(升华) |
300(升华) |
1023 |
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是 (只要求写出一种);
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是 ;
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1="+1344.1kJ" ·mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2="+1169.2kJ" ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 ;
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为 ;
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 。
过氧化钠保存不当容易变质,生成Na2CO3。
(1)某过氧化钠样品已经部分变质,请你选择一种溶液,证明过氧化钠已经变质。
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。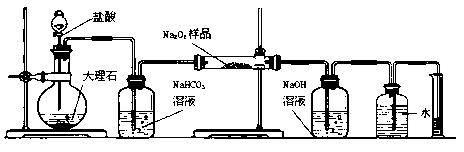
| A. | B. | C. | D.(E)(F) |
上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置B中发生反应的离子方程式:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
下列物质之间有如下反应关系: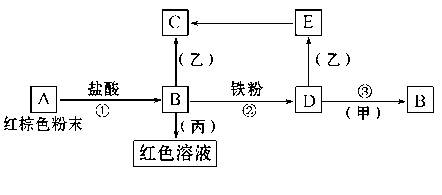
已知由E转化成C的现象是:白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:甲________,丙________。
(2)写出E→C反应的化学方程式:___________________________。为了获得E,可以用新配制的D溶液与用不含O2的蒸馏水配制的乙溶液反应制备。
(3)用相应晶体配制上述D溶液时你觉得还需加入。
(4)写出Fe与H20在一定条件下反应的化学方程式 。
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓)  MnCl2+Cl2↑+ 2H2O
MnCl2+Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是mol,转移电子的物质的量是mol。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 。
(3)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)。
写出下列反应的离子反应方程式(全对得10分,有错即为0分)
(1)NaAlO2溶液中加入少量的盐酸
(2)AlCl3溶液中加入过量的NaOH
(3)Al2O3与NaOH水溶液的反应
(4)Fe3O4溶解在稀盐酸中
(5)FeCl2溶液中加入酸化的H2O2溶液
芳香化合物A、B互为同分异构体,B的结构简式如图所示,A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。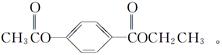
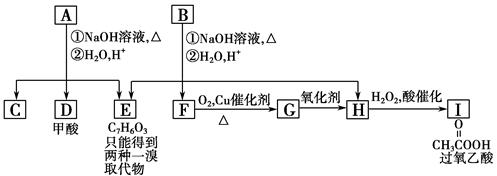
提示:①苯酚既具有酸性,又可与羧酸发生酯化反应。
②酯在NaOH加热的条件下可水解为对应的羧酸钠和醇。
R1COOR2 R1COONa+R2OH
R1COONa+R2OH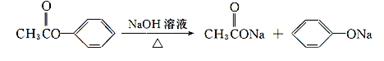
(1)写出E的结构简式____________________________________________________。
(2)A有2种可能的结构,写出相应的结构简式。__________________________________________。
(3)F和小粒金属钠反应的化学方程式是_______________ _______________
(4)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式_ ________。反应类型是____________。
(5)写出F生成G的反应方程式____________________
(6)在B、C、D、F、G、I化合物中,互为同系物的是__________________。