掌握仪器的使用并严格按照操作要求进行实验,是保证化学实验成功和安全的关键,根据所学化学知识,回答下列问题:
(1)将pH试纸用蒸馏水润湿后,测定某酸溶液的pH,测定的结果 (选填“偏大”或“偏小”或“无影响”)
(2)做细铁丝在氧气中燃烧实验时,在集气瓶中预先放一些水的目的是 ;
(3)用氯化钠固体和水配制50g溶质质量分数为6%的氯化钠溶液,在用量筒量取水时仰视读数,其它实验操作均正确,所配制好的溶液溶质质量分数会 (选填“偏大”或“偏小”或“无影响”);
(4)粗盐中难溶性杂质的去除实验步骤是:溶解、过滤、 、计算产率,各实验步骤都要用到的仪器是 。过滤操作中速度慢的原因可能是 。
如图是初中化学部分重要实验的装置图,试回答下列问题: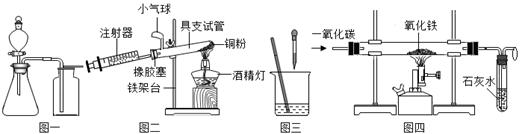
(1)写出一种用图一装置可以制取的气体 ,验满方法为; ;
(2)图二是测定空气中氧气含量的实验.通过该实验可得结论:空气中 ;
(3)图三是酸碱中和反应的实验探究.某同学在烧杯中加入10mL氢氧化钠溶液,用滴管滴入稀盐酸并不断搅拌,再滴入几滴酚酞试液,溶液呈红色,此时烧杯中除酚酞外,还含有的溶质为 (填化学式);
(4)图四是模拟工业炼铁的实验装置,装置后面气球的作用 .
某化学兴趣小组欲除去固体氯化钠中混有少量可溶性氯化镁和难溶性泥沙,设计下图所示实验方案,请参与实验并回答问题。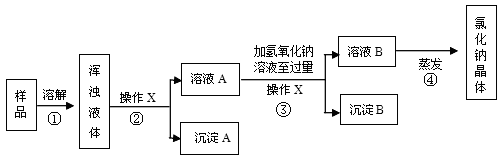
(1)步骤①中玻璃棒搅拌的作用是___________。
(2)步骤②、③中,操作X的名称是________。
(3)步骤③中,加入过量氢氧化钠溶液的目的是_________________________________;沉淀B的化学式是__________。
(4)有同学认为原实验方案不完善,做出这种评价的依据是_____________________。
请根据下列实验装置图回答问题.
(1)写出仪器a、b的名称:a ,b .
(2)用A装置制取O2的化学方程式为 ,应选用的收集装置为 (填装置编号).用B装置制取CO2的化学方程式为 .
(3)如图F是“铁丝在氧气中燃烧”实验的改进装置.实验时,打开分夜漏斗活塞,通入干燥氧气约10秒,引燃铁丝下端火柴杆,伸入塑料瓶内,并对准玻璃管口正上方,观察到的现象是:
铁丝剧烈燃烧, .
改进后的优点是 (填序号).
①氧气无需提前制备和收集,操作更方便
②塑料瓶代替集气瓶,防止集气瓶炸裂,更安全
③装置集氧气的制取、干燥和性质验证于一体,实验更优化
(4)某兴趣小组同学将带火星的木条伸入到收集满氧气的集气瓶内,木条复燃,拿出木条,盖好集气瓶.过一会儿,再用带火星的木条伸入瓶内,木条仍然复燃.重复以上操作,直到木条不再复燃.据此现象 你能得到的结论是 .
我市拥有丰富的海洋资源,开发利用这些宝贵的资源有力地促进了我市经济的发展。
(1)从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质。请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题:
其中操作1的名称是 ;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒、 (填仪器名称);在加热蒸发过程中,当蒸发皿中 时,停止加热。
(2)上述除去泥沙后的澄清滤液中,还含有Ca2+、Mg2+等阳离子。要想知道该滤液是硬水还是软水,
可加入 进行检验。
(3)海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁。工业上从母液中提取氯化镁的过程如下: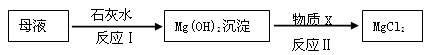
反应1的基本反应类型是 ;物质X是 (填名称)。
(4)工业上可用电解饱和NaCl溶液的方法制得烧碱、氯气和氢气,请写出该反应的化学方程式: ; (5)从下列装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为
(5)从下列装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为
(用接口处字母填写)。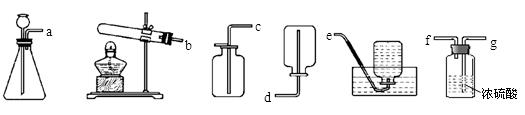
写出一个在实验室中用加热法制取氧气的化学方程式: 。
某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如下图所示,请回答有关问题:
(1)实验进行一段时间之后,A玻璃管内观察到的现象是 。
(2)B装置中氢氧化钠溶液的作用是 。
(3)为避免将CO排放到空气中,并回收利用CO,方框中连接的是C和D装置,导管接口的连接顺序应为
a→ → →
(4)除CO外,还有氢气等物质可以还原Fe2O3,某同学设计了用金属锌粒与稀硫酸反应制取氢气的实验装置,如图所示: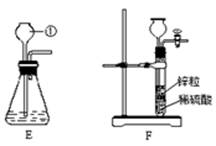
①制取氢气的反应方程式为 。
②用E和F装置制取二氧化碳,F装置与E装置比较,优点是 。